题目内容
4.研究表明:海产品内含有对人体无害的+5价砷(As)元素,但砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜(富含维生素C),否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜.下面有关解释不正确的是( )| A. | 维生素C能将+5价砷氧化成As2O3 | |
| B. | 维生素C具有还原性 | |
| C. | 同时大量食用海鲜和青菜过程中+5价砷发生还原反应 | |
| D. | 同时大量食用海鲜和青菜过程中维生素C被氧化 |
分析 人体中的As元素为+5价,As2O3中As元素为+3价,吃饭时同时大量食用海鲜和青菜,容易中毒的原因是生成+3价As,说明维生素C具有还原性,与+5价砷发生氧化还原反应生成+3价As,据此分析.
解答 解:人体中的As元素为+5价,As2O3中As元素为+3价,吃饭时同时大量食用海鲜和青菜,容易中毒的原因是生成+3价As,
说明维生素C具有还原性,与+5价砷发生氧化还原反应生成+3价As,
A.维生素C具有还原性,维生素C能将+5价砷还原成As2O3,故A错误;
B.人体中的As元素为+5价,大量食用海鲜和青菜后生成+3价As,说明维生素C具有还原性,故B正确;
C.+5价砷生成+3价As,化合价降低,得电子被还原,为还原反应,故C正确;
D.维生素C具有还原性,与+5价砷发生氧化还原反应生成+3价As,+5价As被还原,则维生素C被氧化,故D正确.
故选A.
点评 本题考查氧化还原反应,题目难度不大,侧重于基础知识的考查,注意从化合价变化的角度分析氧化还原反应.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
15.自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4.在该反应中( )
| A. | 产物中的SO42-有一部分是氧化产物 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 发生氧化反应和发生还原反应的FeS2之比为7:3 | |
| D. | 14mol CuSO4能氧化5molFeS2 |
12.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )

| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和8mol 氢气发生加成反应 | |
| C. | 迷迭香酸不可以发生加聚和缩聚反应 | |
| D. | 1mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
19.下列变化中,必须加入氧化剂才能发生的是( )
| A. | H2SO4→SO2 | B. | CO2→CO | C. | Cl2→HCl | D. | Na→NaCl |
9.化学与生产、生活、环境等社会实际密切相关.下列叙述正确的是( )
| A. | 生吃新鲜蔬菜要比熟吃时维生素C的损失大 | |
| B. | 水体中植物营养物质过多积累会引起水体富营养化 | |
| C. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
16.下列物质不属于合金的是( )
| A. | 生铁 | B. | 水银 | C. | 青铜 | D. | 硬铝 |
13.2015年8月12日晚上,天津滨海新区发生危险化学品爆炸事件.据报道,在仓库中存放有金属钠,下列关于钠的说法中不正确的是( )
| A. | 钠保存在煤油中 | B. | 钠着火可以用水浇灭 | ||
| C. | 钠在自然界中以化合态存在 | D. | 钠的焰色反应呈黄色 |
14.某同学用如图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是( )


| A. | ①和②中发生的反应均为复分解反应 | |
| B. | 向Na2SiO3饱和溶液中滴酚酞溶液无明显现象 | |
| C. | 一段时间后②中有胶冻状物质生成 | |
| D. | 该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸 |
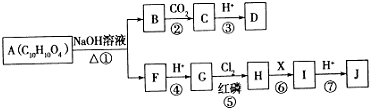
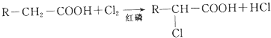
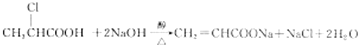 .
.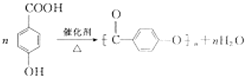 .
. .
.