题目内容
10.由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol晶体硅的热效应是( )| 化学键 | Si-Cl | H-H | Si-Si | H-Cl |
| 键能(kJ/mol) | 360 | 436 | 176 | 431 |
| A. | 吸收236kJ | B. | 放出236kJ | C. | 放出116kJ | D. | 吸收116kJ |
分析 化学反应方程式中的反应热=反应物的键能之和-生成物的键能之和;在硅晶体中每个硅原子和其它4个硅原子形成4个共价键,所以每个硅原子含有2个共价键,据此列式计算.
解答 解:反应热=反应物的键能之和-生成物的键能之和,则该反应的焓变△H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236 kJ/mol,
即:生成1mol晶体硅需要吸收236kJ的热量,
故选A.
点评 本题考查反应热的计算,侧重于反应热的计算,题目难度中等,注意原子晶体中键能的计算方法,明确焓变与反应物、生成物键能的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.乙醇(C2H6O)的结构可能有两种 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
 关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )
关于确定是(Ⅱ)而不是(Ⅰ),下列说法正确的是( )| A. | 乙醇可以用来制饮料 | |
| B. | 1 mol乙醇完全燃烧时生成3mol水 | |
| C. | 1mol乙醇与足量的钠作用生成1g H2 | |
| D. | 物质的量相同的乙醇和乙烯气体完全燃烧,耗氧量相同 |
1.下列物质中,有极性共价键的是( )
| A. | 氯化镁 | B. | 过氧化钠 | C. | 单质碘 | D. | 水 |
18.二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
回答下列问题:
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是反应消耗了H2O(g)有利于反应Ⅱ、Ⅲ正向移动;同时此反应生成了H2,有利于反应I、Ⅲ正向移动.
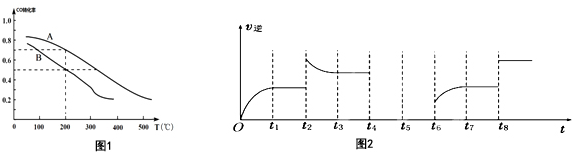
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是升高温度或增大生成物浓度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是反应消耗了H2O(g)有利于反应Ⅱ、Ⅲ正向移动;同时此反应生成了H2,有利于反应I、Ⅲ正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是升高温度或增大生成物浓度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.

5.仅用蒸馏水,不能鉴别的一组物质是( )
| A. | 汽油、甘油和四氯化碳 | B. | 葡萄糖、蔗糖和纯碱 | ||
| C. | 溴蒸气和二氧化氮 | D. | 碘和高锰酸钾 |
15.自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4.在该反应中( )
| A. | 产物中的SO42-有一部分是氧化产物 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 发生氧化反应和发生还原反应的FeS2之比为7:3 | |
| D. | 14mol CuSO4能氧化5molFeS2 |
2.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 苯 己烷 | B. | 苯 甲苯 | C. | 乙烷 丙烷 | D. | 乙烯 乙炔 |
19.下列变化中,必须加入氧化剂才能发生的是( )
| A. | H2SO4→SO2 | B. | CO2→CO | C. | Cl2→HCl | D. | Na→NaCl |
20.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 柠檬属于酸性食物 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |