题目内容
7.下列说法错误的是( )| A. | 提纯液体混合物常用重结晶法 | |
| B. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| C. | 萃取是利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 | |
| D. | 常用质谱法进行有机物相对分子质量的测定 |
分析 A.液体混合物,一般利用沸点差异分离;
B.蒸馏时,测定馏分的温度;
C.萃取与溶质在不同溶剂中的溶解度有关;
D.质谱法可测定有机物的相对分子质量.
解答 解:A.液体混合物,一般利用沸点差异分离,则提纯液体混合物常用蒸馏法,故A错误;
B.蒸馏时,测定馏分的温度,则应调整温度计的水银球于蒸馏烧瓶支管口附近,故B正确;
C.萃取与溶质在不同溶剂中的溶解度有关,则利用溶质在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作为萃取,故C正确;
D.质谱法可测定有机物的相对分子质量,为有机物实验式和分子式确定中常用的方法,故D正确;
故选A.
点评 本题考查混合物分离、提纯方法及原理,为高频考点,把握混合物分离方法及操作原理为解答的关键,注意固体物质的提纯可利用结晶法,题目难度不大.

练习册系列答案
相关题目
17.化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:下列有关叙述正确的是( )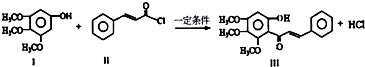

| A. | Ⅰ在空气中不能稳定存在 | |
| B. | 可用FeCl3溶液鉴别有机物Ⅱ和Ⅲ | |
| C. | Ⅱ中所有原子一定不可能共面 | |
| D. | 1mol产物Ⅲ与足量溴水反应,消耗Br2 的物质的量为1.5mol |
18.二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
回答下列问题:
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是反应消耗了H2O(g)有利于反应Ⅱ、Ⅲ正向移动;同时此反应生成了H2,有利于反应I、Ⅲ正向移动.
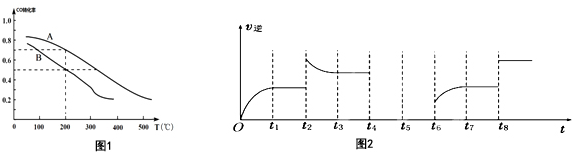
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是升高温度或增大生成物浓度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.
反应Ⅰ:CO(g)+2H2(g)?CH3OH(g)△H1
反应Ⅱ:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2
反应Ⅲ:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H3
相关反应在不同温度时的平衡常数及其大小关系如下表所示
| 温度/K | 反应Ⅰ | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
(1)反应Ⅰ的△S<0(填“>”或“<”);反应Ⅱ的平衡常数表达式为$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$,反应Ⅲ是放热反应(填“吸热”或“放热”).
(2)在合成过程中,因为有CO(g)+H2O(g)?CO2(g)+H2(g)反应发生,所以能提高CH3OCH3的产率,原因是反应消耗了H2O(g)有利于反应Ⅱ、Ⅲ正向移动;同时此反应生成了H2,有利于反应I、Ⅲ正向移动.
(3)如图1两条曲线分别表示反应I(按物质的量比:n(CO):n(H2)=1:2)中压强为0.1MPa和5.0MPa下CO转化率随温度的变化关系,计算压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是25%.
(4)反应Ⅲ逆反应速率与时间的关系如图2所示:
①试判断t2时改变的条件是升高温度或增大生成物浓度.
②若t4扩大容器体积,t5达到平衡,t6时增大反应物浓度,请在图2中画出t4-t6的变化曲线.

15.自然界存在反应:14CuSO4+5FeS2+12H2O→7Cu2S+5FeSO4+12H2SO4.在该反应中( )
| A. | 产物中的SO42-有一部分是氧化产物 | |
| B. | 5molFeS2发生反应,有10mol电子转移 | |
| C. | 发生氧化反应和发生还原反应的FeS2之比为7:3 | |
| D. | 14mol CuSO4能氧化5molFeS2 |
2.能用酸性高锰酸钾溶液鉴别的一组物质是( )
| A. | 苯 己烷 | B. | 苯 甲苯 | C. | 乙烷 丙烷 | D. | 乙烯 乙炔 |
12.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图.下列叙述正确的是( )

| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和8mol 氢气发生加成反应 | |
| C. | 迷迭香酸不可以发生加聚和缩聚反应 | |
| D. | 1mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
19.下列变化中,必须加入氧化剂才能发生的是( )
| A. | H2SO4→SO2 | B. | CO2→CO | C. | Cl2→HCl | D. | Na→NaCl |
16.下列物质不属于合金的是( )
| A. | 生铁 | B. | 水银 | C. | 青铜 | D. | 硬铝 |
17. 用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )
用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )
 用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )
用下列装置(尾气处理已略去)进行相关实验,能实现实验目的是( )| 实验目的 | a中试剂 | b中试剂 | c中试剂 | |
| A | 比较H2CO3、H2SiO3 的酸性 | 醋酸溶液 | 碳酸钠 | 硅酸钠溶液 |
| B | 比较Cl2、I2的 氧化性 | 浓盐酸 | 高锰酸钾 | 碘化钾溶液 |
| C | 制备NaHCO3 | 盐酸 | 大理石 | 饱和碳酸钠溶液 |
| D | 证明C2H2有还原性 | 饱和食盐水 | 电石 | 酸性高锰酸钾溶液 |
| A. | A | B. | B | C. | C | D. | D |