题目内容
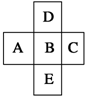 在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )
在元素周期表中的前四周期,两两相邻的5种元素如图所示,若B元素的核电荷数为a.下列说法正确的是( )| A、B、D的原子序数之差可能为2 |
| B、E、B的原子序数之差可能是8、18或32 |
| C、5种元素的核电荷总数之和可能为5a+10 |
| D、A、E的原子序数之差可能是7 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由四种元素在周期表中的位置可知,D、B、E分别在周期表的第二、三、四周期,若B元素的核电荷数为a,则A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,则五种元素的核电荷总数之和为:a+a-1+a+1+a-8+a+18=5a+10,据此对各选项进行判断.
解答:
解:由四种元素在周期表中的位置可知,D、B、E分别在周期表的第二、三、四周期,若B元素的核电荷数为a,
则A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,
则五种元素的核电荷总数之和为:a+a-1+a+1+a-8+a+18=5a+10,
A.根据分析可知,B、D的原子序数之差为8,不可能为2,故A错误;
B.B、E的原子序数之差为18,故B错误;
C.A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,则五种元素的核电荷总数之和为:a+a-1+a+1+a-8+a+18=5a+10,故C正确;
D.A、E的原子序数之差为:a+18-(a-1)=19,故D错误;
故选C.
则A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,
则五种元素的核电荷总数之和为:a+a-1+a+1+a-8+a+18=5a+10,
A.根据分析可知,B、D的原子序数之差为8,不可能为2,故A错误;
B.B、E的原子序数之差为18,故B错误;
C.A的原子序数为a-1,C的原子序数为a+1,D的原子序数为a-8,E的原子序数为a+18,则五种元素的核电荷总数之和为:a+a-1+a+1+a-8+a+18=5a+10,故C正确;
D.A、E的原子序数之差为:a+18-(a-1)=19,故D错误;
故选C.
点评:本题考查位置结构与性质的关系,题目难度不大,本题注意把握元素周期表的结构特点,为常考查的知识,注意把握元素周期表的组合规律.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
VmLAl2(SO4)3溶液中含Al3-ag,取
mL溶液加水稀释到10VmL,则稀释后溶液中SO42-的物质的量浓度是( )
| V |
| 10 |
A、
| ||
B、
| ||
C、
| ||
D、
|
对于某些离子的检验及结论正确的是( )
| A、加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- |
| B、加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- |
| C、某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
| D、某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ |
下列说法正确的是( )
| A、乙醇在水溶液中电离出少量H+,它的水溶液具有酸性 |
| B、乙醇分子中的氢均可被金属钠置换 |
| C、乙醇跟乙酸反应生成乙酸乙酯,说明乙醇具有碱性 |
| D、在一定条件下,乙醇能发生氧化反应 |
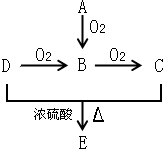 已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.
已知A、B、C、D和E五种有机物存在如图所示的转化关系.A是一种标准状况下密度为1.25g.L-1的烃,E是一种有水果香味的有机物.