题目内容
9.有三种常见金属单质A、B、C,三种金属单质中A的密度最小,A通常保存在煤油中.A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应物的产物和反应的条件没有标出).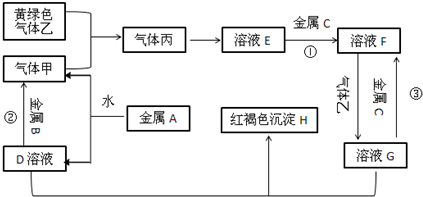
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙Cl2、HFe(OH)3.
(2)写出反应②的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)F与D溶液反应后的产物在空气中转化为H的化学方程式为4Fe(OH)2+O2+2H2O=4 Fe(OH)3.现象为白色沉淀变成灰绿色,最后变成红褐色.
分析 三种常见金属单质A、B、C,三种金属单质中A的密度最小,A通常保存在煤油中,则A为金属Na,钠与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,据此解答.
解答 解:三种常见金属单质A、B、C,三种金属单质中A的密度最小,A通常保存在煤油中,则A为金属Na,钠与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3.
(1)由上述分析可知,乙为Cl2,H为Fe(OH)3,故答案为:Cl2;Fe(OH)3;
(2)反应②的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)F与D溶液反应后的产物在空气中转化为H的化学方程式为:4Fe(OH)2+O2+2H2O=4 Fe(OH)3,现象为:白色沉淀变成灰绿色,最后变成红褐色,
故答案为:4Fe(OH)2+O2+2H2O=4 Fe(OH)3;白色沉淀变成灰绿色,最后变成红褐色.
点评 本题是考查物质推断,涉及Na、Fe、Al元素单质化合物的性质及相互转化,注意特殊的颜色与特殊反应是推断的突破口,难度中等,需要学生熟练掌握元素化合物知识.

 全优点练单元计划系列答案
全优点练单元计划系列答案| A. | 氯气是一种有刺激性气味的气体 | B. | 氯气,液氯,氯水是同一种物质 | ||
| C. | 氯气能溶于水 | D. | 氯气是一种有毒气体 |
| A. | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有SO42- | |
| B. | 向某溶液中加入烧碱溶液,加热,用湿润红色石蕊试纸检验,石蕊试纸变蓝色,该溶液中一定含有NH4+ | |
| C. | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液,有白色沉淀生成,该溶液中一定含有Cl- |
| A. | 氯离子的结构示意图: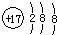 | |
| B. | 作为相对原子质量测定标准的碳核素:${\;}_6^{14}$C | |
| C. | 氯化镁的电子式: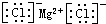 | |
| D. | 乙烯结构简式CH2=CH2 |
| A. | $\frac{4}{100+2.3}$×100% | B. | $\frac{2.3}{100+2.3-1.8}$×100% | ||
| C. | $\frac{2.3}{100+4}×100%$ | D. | $\frac{4}{100+2.3-0.1}$×100% |
| A. | 酸式滴定管未用待测盐酸润洗 | |
| B. | 碱式滴定管未用标准碱液润洗 | |
| C. | 锥形瓶用蒸馏水洗净后未用待测液润洗 | |
| D. | 滴定前仰视读数,滴定后平视读数 |
| A. | Al3+ | B. | CO32- | C. | NH4+ | D. | Br- |
| A. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| B. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| C. | NO的摩尔质量为30g | |
| D. | 常温常压下32g臭氧中含有的氧原子数目比标准状况下22.4L氧气中含有的氧原子数目少 |