题目内容
12.3.1g磷原子有0.1mol磷原子,有0.1NA个磷原子,有1.5NA个电子.分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$结合1个P含有15个电子解答.
解答 解:3.1g磷原子物质的量为$\frac{3.1g}{31g/mol}$=0.1mol,含有P原子个数为0.1mol×NA=0.1NA,含有电子数为:0.1NA×15=1.5NA,
故答案为:0.1;0.1NA;1.5NA.
点评 本题考查了物质的量相关计算,熟悉以物质的量为核心的计算公式是解题关键,注意磷原子结构组成,题目难度不大.

练习册系列答案
相关题目
3.下列有关试验的做法不正确的是( )
| A. | 用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 | |
| B. | 配置0.1000mol•L-1氢氧化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流 | |
| C. | 检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 | |
| D. | 分液时,分液漏斗的顶塞应打开或使塞上凹槽与壁上小孔对准 |
20. 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】
(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越小(填“大”或“小”),分子的速率越快(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红分别滴入到等量的热水和冷水中,其实验现象如下所示.
依据此实验现象,得出的结论是温度越高,分子的运动越快.
 探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.
探究实验展示了化学的无穷魅力.我们在实验的过程中也提炼了许多探究方法.【提出问题】小松想探究分子的运动速率与相对分子质量的关系.
【假设猜想】①分子质量(相对分子质量)越大,分子运动速率越快;②分子质量(相对分子质量)越小,分子运动速率越快.
【查阅资料】已知浓氨水能挥发出氨气,浓盐酸能挥发出氯化氢气体,二者接触反应会产生白烟(即氯化铵固体).
【设计实验】如图所示,在玻璃管两端分别放入蘸有浓氨水和浓盐酸的棉花团.
【实验现象】C处产生的白烟较多.
【解释与结论】
(1)氨分子的相对分子质量小于(填“大于”、“等于”或“小于”)氯化氢分子的相对分子质量,由此可知,相对分子质量越小(填“大”或“小”),分子的速率越快(填“快”或“慢”).
(2)反应的化学方程式为NH3+HCl═NH4Cl.
【拓展探究】小松在完成上述实验后,还想研究分子运动速率与温度的关系.
他将等量的品红分别滴入到等量的热水和冷水中,其实验现象如下所示.
| 实验过程 | 冷水 | 热水 |
| 开始 | 红色扩散较慢 | 红色扩散较快 |
| 长久放置 | 最终均成为红色、均匀、透明的液体 | |
1.近日,我国不少城市出现了罕见的连续雾霾天气,导致当下雾霾天气的主要原因是化石燃料的大量使用,下列与治理雾霾天气的相关说法不正确的是( )
| A. | 推广燃煤脱硫技术,减少SO2污染,同时把煤粉碎了再燃烧以提高煤的燃烧效率 | |
| B. | 开发新能源,如太阳能、风能等,减少对化石能源的依赖 | |
| C. | 推广煤的气化、液化技术,提供清洁燃料和化工原料 | |
| D. | 在汽车尾气处理器中使用新的催化剂,促使平衡2CO+2NO?2CO2+N2向正反应方向移动,减少污染物的排放 |
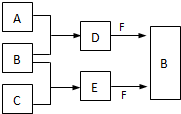 A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答:
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).试回答: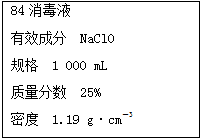 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
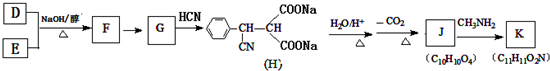
 ,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.
,则 D 的核磁共振氢谱有6种峰.F 中的无氧官能团为碳碳双键.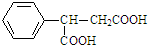 +CH3NH2$\stackrel{一定条件下}{→}$
+CH3NH2$\stackrel{一定条件下}{→}$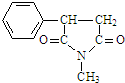 +2H2O.
+2H2O.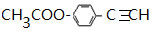 .
.