题目内容
由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转换关系,A是地壳中含量最多的金属元素.请回答:
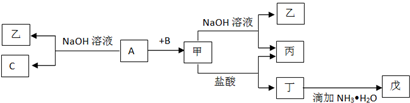
(1)写出下列物质的化学式:乙 、丁 、戊 .
(2)写出甲物质在工业上的一种主要用途: .
(3)写出A在元素周期表中的位置:第 周期,第 族.
(4)写出甲→乙+丙反应的离子方程式: ;A→乙+C反应的化学方程式: .

(1)写出下列物质的化学式:乙
(2)写出甲物质在工业上的一种主要用途:
(3)写出A在元素周期表中的位置:第
(4)写出甲→乙+丙反应的离子方程式:
考点:无机物的推断,镁、铝的重要化合物
专题:推断题,几种重要的金属及其化合物
分析:A是地壳中含量最多的金属元素,则A为Al,Al与NaOH溶液反应生成C单质及乙,则C为H2,乙为NaAlO2.Al与单质B化合生成甲,能与氢氧化钠溶液、盐酸反应,则甲为Al2O3,B为O2,结合转化关系可知,丙为H2O,丁为AlCl3,丁与氨水反应生成戊为Al(OH)3,据此解答.
解答:
解:A是地壳中含量最多的金属元素,则A为Al,Al与NaOH溶液反应生成C单质及乙,则C为H2,乙为NaAlO2.Al与单质B化合生成甲,能与氢氧化钠溶液、盐酸反应,则甲为Al2O3,B为O2,结合转化关系可知,丙为H2O,丁为AlCl3,丁与氨水反应生成戊为Al(OH)3,
(1)由上述分析可知,乙、丁、戊分别为NaAlO2、AlCl3、Al(OH)3,
故答案为:NaAlO2;AlCl3;Al(OH)3;
(2)甲为Al2O3,含金属元素Al,且熔点较高,则可冶炼金属铝的原料或做耐火材料(坩埚等),
故答案为:冶炼金属铝的原料或做耐火材料(坩埚等);
(3)Al元素处于周期表中第三周期ⅢA,故答案为:三;ⅢA;
(4)甲→乙+丙反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
A→乙+C反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al2O3+2OH-=2AlO2-+H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
(1)由上述分析可知,乙、丁、戊分别为NaAlO2、AlCl3、Al(OH)3,
故答案为:NaAlO2;AlCl3;Al(OH)3;
(2)甲为Al2O3,含金属元素Al,且熔点较高,则可冶炼金属铝的原料或做耐火材料(坩埚等),
故答案为:冶炼金属铝的原料或做耐火材料(坩埚等);
(3)Al元素处于周期表中第三周期ⅢA,故答案为:三;ⅢA;
(4)甲→乙+丙反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
A→乙+C反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al2O3+2OH-=2AlO2-+H2O;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评:本题考查无机物的推断,Al为解答本题的突破口,把握Al及其化合物的性质为解答本题的关键,注意氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
白磷(P4)分子呈正四面体结构,如图所示: .意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )
.意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )
 .意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )
.意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )| A、N4转化为N2的过程是一个放热过程 |
| B、N4的沸点比P4(白磷)的高 |
| C、N4与N2互为同分异构体 |
| D、N4晶体属于原子晶体 |
某溶液中存在五种离子:NO3-、SO42-、Fe3+、H+和一种未知离子,它们物质的量浓度之比为2:3:1:3:1,则未知离子可能为( )
| A、Fe2+ |
| B、Ba2+ |
| C、C1- |
| D、Mg2+ |
下列选项中所涉及到的两个量一定相等的是( )
| A、等物质的量的A1分别与足量的盐酸、烧碱反应转移的电子数 |
| B、36gH2O和1.204×1024个O2在标准状况下所占体积 |
| C、pH相等的氨水与醋酸钠溶液中由水电离出的OH-浓度 |
| D、pH相等的H2SO4和CH3COOH稀释相同倍数之后溶液的pH值 |
关于胶体和溶液的区别,下列叙述中正确的是( )
| A、电解质溶液呈电中性,胶体带电荷 |
| B、溶液中溶质粒子的运动有规律,而胶体粒子的运动无规律 |
| C、溶液中溶质粒子一定不带电,胶体中分散质粒子带有电荷,且通电后溶质粒子分别向两极移动,胶体粒子向某一极移动 |
| D、溶液中通过一束光线时无特殊现象,胶体中通过一束光线时有明显的光带 |


 图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:
图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知: