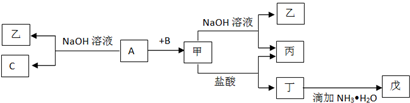
题目内容
白磷(P4)分子呈正四面体结构,如图所示: .意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )
.意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )
 .意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )
.意大利罗马大学的Fulvio Cacace教授受白磷分子结构的启发又合成了和白磷分子极具类似的N4分子.已知断裂1mol N-N键需吸收167kJ的能量,生成1mol N≡N键放出942kJ的能量.判断下列说法正确的是( )| A、N4转化为N2的过程是一个放热过程 |
| B、N4的沸点比P4(白磷)的高 |
| C、N4与N2互为同分异构体 |
| D、N4晶体属于原子晶体 |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:A.根据键能求反应热然后判断;
B.N4和P4均为分子晶体,沸点高低与它们的相对分子质量大小有关;
C.N4与N2分子式不同不互为同分异构体;
D.N4晶体属于分子晶体.
B.N4和P4均为分子晶体,沸点高低与它们的相对分子质量大小有关;
C.N4与N2分子式不同不互为同分异构体;
D.N4晶体属于分子晶体.
解答:
解:A.N4=2N2的△H=反应物键能总和-生成物键能总和=167kJ/mol×6-942kJ/mol×2=-882kJ/mol,故为放热反应,故A正确;
B.N4和P4均为分子晶体,后者相对分子质量大沸点高,故B错误;
C.N4与N2分子式不同不互为同分异构体,故C错误;
D.N4晶体属于分子晶体,故D错误;
故选:A.
B.N4和P4均为分子晶体,后者相对分子质量大沸点高,故B错误;
C.N4与N2分子式不同不互为同分异构体,故C错误;
D.N4晶体属于分子晶体,故D错误;
故选:A.
点评:本题综合考查了物质结构与性质的关系以及反应热的计算,比较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
| A、强电解质溶液的导电能力一定比弱电解质溶液强 |
| B、中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多 |
| C、如果盐酸的浓度是醋酸的两倍,则盐酸的H+浓度也是醋酸的二倍 |
| D、物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO43-不同 |
区别棉花和羊毛的最简便方法是( )
| A、加稀盐酸 | B、加硝酸银溶液 |
| C、加入碘水 | D、在火中灼烧 |
甘油三油酸脂是一种典型的脂肪,当它在人体内代谢时发生下列反应C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)△H=-3.35×10 4 kJ?mol-1问如以高中男生平均每人每日耗能10125.3kJ,且以完全消耗这种脂肪来计算,每天需消耗甘油三油酸脂约( )
| A、1.2mol |
| B、0.6mol |
| C、0.3mol |
| D、0.15mol |
用nA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、常温常压下,200g 8.5%的H2O2水溶液中含氧原子总数为nA |
| B、.标准状况下,22.4LCHCI3中含C-H键数目为nA |
| C、.常温下,14g丙烯(CH3CH=CH2)中含碳原子数为nA |
| D、.常温下,pH=13的氢氧化钠溶液中,含OH一数目为nA |
将一定量甘油[C3H5(OH)3]溶于甲苯中( ),混合液中氢元素质量分数为( )
),混合液中氢元素质量分数为( )
 ),混合液中氢元素质量分数为( )
),混合液中氢元素质量分数为( )| A、无法计算 | B、8.7% |
| C、17.4% | D、4.35% |
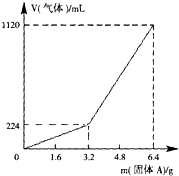 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol?L-1盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图15所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).