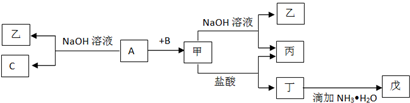
题目内容
 图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:
图中,A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:①G是一种红棕色固体粉末,反应C+G
| 高温 |
②I是一种常见的温室气体,E原子核内有12个质子,E能在I中燃烧,反应:2E+I-→2F+D,产物F为白色固体,D为黑色固体.回答问题:
(1)①中反应C+G
| 高温 |
(2)G溶于盐酸,得到的溶液与铜粉完全反应,写出涉及的离子方程式:
(3)C与过量NaOH溶液反应的离子方程式为
(4)②反应2E+I-→2F+D的化学方程式为
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:①G是一种红棕色固体粉末,反应C+G
B+H能放出大量的热,该反应曾应用于铁轨的焊接,为铝热反应,可推知C为Al、G为Fe2O3,B为Fe,H为Al2O3;②E原子核内有12个质子,则E为Mg,I是一种常见的温室气体,E能在I中燃烧,反应:2E+I→2F+D,产物F为白色固体,D为黑色固体,可推知I为CO2,F为MgO,D为碳单质,结合转化关系可知A为O2,据此解答.
| 高温 |
解答:
解:A为空气中常见的气体单质,B、C、E是金属单质,D为非金属单质.已知:①G是一种红棕色固体粉末,反应C+G
B+H能放出大量的热,该反应曾应用于铁轨的焊接,为铝热反应,可推知C为Al、G为Fe2O3,B为Fe,H为Al2O3;②E原子核内有12个质子,则E为Mg,I是一种常见的温室气体,E能在I中燃烧,反应:2E+I→2F+D,产物F为白色固体,D为黑色固体,可推知I为CO2,F为MgO,D为碳单质,结合转化关系可知A为O2,
(1)①中反应C+G
B+H的化学方程式为:2Al+Fe2O3
2Fe+Al2O3,
故答案为:2Al+Fe2O3
2Fe+Al2O3;
(2)Fe2O3溶于盐酸得到氯化铁溶液,氯化铁溶液与铜粉完全反应生成氯化亚铁与Cu,故涉及的反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+;
(3)Al与过量NaOH溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)②反应2E+I→2F+D的化学方程式为:2Mg+CO2
2MgO+C,现象为:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳,
故答案为:2Mg+CO2
2MgO+C;镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.
| 高温 |
(1)①中反应C+G
| 高温 |
| ||
故答案为:2Al+Fe2O3
| ||
(2)Fe2O3溶于盐酸得到氯化铁溶液,氯化铁溶液与铜粉完全反应生成氯化亚铁与Cu,故涉及的反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+;
(3)Al与过量NaOH溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)②反应2E+I→2F+D的化学方程式为:2Mg+CO2
| ||
故答案为:2Mg+CO2
| ||
点评:本题考查无机物的推断,难度中等,掌握Mg在二氧化碳中燃烧时推断的关键,注意元素化合物性质的全面掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用nA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A、常温常压下,200g 8.5%的H2O2水溶液中含氧原子总数为nA |
| B、.标准状况下,22.4LCHCI3中含C-H键数目为nA |
| C、.常温下,14g丙烯(CH3CH=CH2)中含碳原子数为nA |
| D、.常温下,pH=13的氢氧化钠溶液中,含OH一数目为nA |
固体甲与盐酸反应得到溶液乙,乙与氢氧化钠溶液反应生成沉淀丙,一段时间后,将丙加热又得到甲,则甲可能是( )
| A、Fe | B、A1 |
| C、FeO | D、CuO |
有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol?L-1,SO42-的浓度是0.7mol?L-1,则Al3+浓度最接近于( )
| A、0.4mol?L-1 |
| B、0.2mol?L-1 |
| C、0.3mol?L-1 |
| D、0.6mol?L-1 |