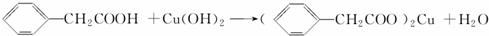题目内容
9.在0.1mol•L-1CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )| A. | 加入水时,平衡向正反应方向移动,c(H+)增大 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动,c(H+)减少 | |
| C. | 加入少量0.1mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动,c(CH3COO-)增大 |
分析 A.加水稀释促进弱电解质的电离,并使得电离方程式中各粒子的浓度减小;
B.加入少量NaOH固体降低了c(H+),平衡向正反应方向移动;
C.加入少量0.1mol•L-1 HCl溶液,增大了c(H+),电离平衡逆向移动;
D.加入少量CH3COONa固体,增大了c(CH3COO-),电离平衡逆向移动.
解答 解:A.加入水时,醋酸的电离平衡正向移动,c(H+)减小,故A错误;
B.加入少量NaOH固体中和了H+,降低了c(H+),平衡向正反应方向移动,故B正确;
C.醋酸部分电离,0.1mol•L-1CH3COOH溶液中c(H+)小于0.1mol•L-1,加入少量0.1mol•L-1 HCl溶液,增大了c(H+),电离平衡逆向移动,故C错误;
D.加入少量CH3COONa固体,增大了溶液中c(CH3COO-),电离平衡逆向移动,故D错误;
故选B.
点评 本题考查了弱电解质的电离平衡,难度不大,搞清楚条件是如何改变的,进而准确判断出电离平衡移动的方向是解题的关键,注意条件的改变大于平衡移动的改变.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
17.下列溶液一定是碱性的是( )
| A. | 溶液中含有OH- | B. | 滴加甲基橙后溶液显红色 | ||
| C. | 溶液中c(OH-)>c(H+) | D. | 滴加甲基橙后溶液显黄色 |
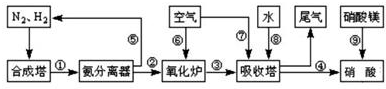
4. 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1 (填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1< 573K(填“>”、“<”或“=”).
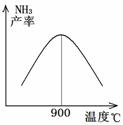
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动.
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
 工业合成氨与制备硝酸一般可连续生产,流程如图所示:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1 (填计算结果).
(2)合成塔中发生反应N2(g)+3H2(g)?2NH3(g);△H<0.下表为不同温度下该反应的平衡常数.由此可推知,表中T1< 573K(填“>”、“<”或“=”).
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1
(5)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=N2+6H2O.
1.某温度下,浓度都是1mol•L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为c(X2)=0.4mol•L-1,c(Y2)=0.6mol•L-1,c(Z)=0.4mol•L-1,则该反应的化学方程式可表示为( )
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y22?XY2 | D. | 2X2+Y2?2X2Y |
18.下面是有关弱酸的电离平衡常数
结合数据,分析下列有关说法,其中错误的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 1mol•L-1的溶液中,pH(HCN)>pH(H2CO3)>pH(CH3COOH) | |
| B. | 升高温度,HCN溶液中HCN的电离平衡正向移动,电离平衡常数增大 | |
| C. | 0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比小于2:1 | |
| D. | 饱和H2CO3溶液中c(H+)与c(CO32-)的比值小于2:1 |
 常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:
常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题: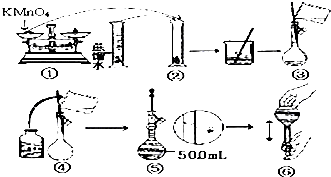 人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
人体血液里Ca2+离子的浓度一般采用g/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得一种弱酸草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度: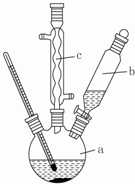 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: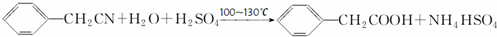 ;
;