题目内容
10.常温下,下列溶液中的粒子浓度关系正确的是( )| A. | NH4Cl溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| B. | Na2SO4溶液中:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| C. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中:c (CH3COOH)+c(CH3COO-)=0.2mol/L |
分析 A.铵根离子部分水解,溶液呈酸性,则c(H+)>c(OH-);
B.根据硫酸钠溶液中的电荷守恒判断;
C.碳酸氢根离子部分水解,溶液呈碱性,则c(OH-)>c(H+);
D.根据混合液中的物料守恒判断.
解答 解:A.NH4Cl溶液中,铵根离子发生水解,溶液呈酸性,则c(Cl-)>c(NH4+)、c(H+)>c(OH-),正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.Na2SO4溶液中,根据电荷守恒可知:c(Na+)+c(H+)=2c(SO42-)+c(OH-),故B正确;
C.碳酸氢钠溶液中,碳酸氢根离子发生水解,溶液呈碱性,正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c(H+),故C错误;
D.浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合所得溶液中,由于体积增大一倍,则混合液中满足:c (CH3COOH)+c(CH3COO-)=0.1mol/L,故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法不正确的是( )
| A. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 | |
| B. | 废旧电池不能随意丢弃,要进行深埋处理,防止重金属污染 | |
| C. | “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 | |
| D. | 人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的 |
1.过氧化铬(CrO5)的结构如右图,由此可推知在CrO5中氧元素的化合价应该是( )
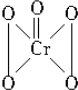

| A. | 全部-1价 | B. | $\frac{4}{5}$为-1价,$\frac{1}{5}$为-2价 | ||
| C. | 全部-2价 | D. | $\frac{4}{5}$为-2价,$\frac{1}{5}$为-1价 |
18.相同体积pH=3的强酸溶液和弱酸溶液分别与足量的镁完全反应,下列说法正确的是( )
| A. | 两者产生等量的氢气 | B. | 强酸溶液产生氢气的速度快 | ||
| C. | 弱酸溶液产生较多的氢气 | D. | 无法比较两者产生氢气的量 |
5.下列叙述中正确的是( )
| A. | 可用明矾和漂白粉处理自来水,二者的作用原理相同 | |
| B. | 室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| D. | 可用澄清的石灰水鉴别碳酸钠和碳酸氢钠 |
15.用铑的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g).下列有关焓变与熵变说法不正确的是( )
| A. | 该反应的△S>0 | |
| B. | 该反应的△H<0 | |
| C. | 该反应的逆反应在一定条件下也能自发进行 | |
| D. | 该反应的熵变效应大于焓变效应 |
2.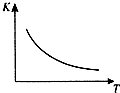 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
(1)Q<0(填“>”、“=”或“<”).
(2)若在850℃时向反应容器中充人H2O(g),K 值不变(填“增大”、“减小”或“不变”).
(3)上表中 c2为0.18mol/L,CO(g)的转化率为60%.
 工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:
工业上制备H2的一种重要方法是:CO(g)+H2O(g)?CO2 (g)+H2(g)△H=Q kJ/mol.已知该反应的平衡常数K与温度T的关系如图所示.若在一固定容积的密闭容器中,850℃时发生上述反应,测得容器内各物质的浓度 (mol/L)随时间的变化关系如表:已知:850℃时该反应的化学平衡常数K=1.0,请回答下列问题:| 时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
(2)若在850℃时向反应容器中充人H2O(g),K 值不变(填“增大”、“减小”或“不变”).
(3)上表中 c2为0.18mol/L,CO(g)的转化率为60%.
20.X、Y、Z均为短周期主族元素,其核电荷数依次增大,且它们的原子最外层电子数之比为1:4:2.下列叙述中正确的是( )
| A. | X一定是碱金属元素 | |
| B. | Y元素能形成化合物Na2YO3,且其水溶液呈碱性 | |
| C. | Z元素形成的最高价氧化物熔点较低 | |
| D. | X的单质一定能通过电解Z的盐酸盐溶液制备 |