题目内容
19. A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.请回答下列问题:
(1)元素B、C、D的第一电离能由大到小的顺序为:N>O>C(用元素符号表示).
(2)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是:sp2.
(3)E的单质与水反应的化学方程式:2H2O+2F2=4HF+O2↑.
(4)元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p轨道上有4个电子.
①X与Y所形成化合物中X的化合价等于其族序数,Y达到8电子的稳定结构,则该化合物的化学式为:ZnS.
②乙醇在D的氢化物(H2D)中的溶解度大于H2Y在D的氢化物(H2D)中的溶解度,其原因是:乙醇分子与水分子之间形成氢键而H2S分子与水分子之间不形成氢键.
③X的氯化物与氨水反应可形成配合物[X(NH3)4]CI2该配合物中含有o键的数目为:16.
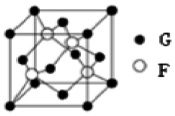
(5)F与G所形成化合物晶体的晶胞如图所示.
①在元素周期表中,元素G位于ds区.
②在1个晶胞中,该化合物的化学式为:CuCl.
已知该晶体的密度为pg•cm-3,阿伏加德罗常数为NA,则该晶体中F原子和G原子之间的最短距离为:$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm(只写计算式)(F原子位于体对角线上)
分析 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,则A为H元素;化合物CD2为红棕色气体,该气体为NO2,则C为N、D为O元素;B原子最外层有两个未成对电子,其原子序数小于N,则B为C元素;E的单质易与水反应且只作氧化剂,则E为F元素;元素F基态原子的3p轨道上有5个电子,则F含有3个电子层,最外层含有7个电子,为Cl元素;G是第四周期元素,最外层只有一个电子,其余各层电子均充满,核外电子数=2+8+18+1=29,则G为Cu元素;
(4)元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素,据此进行解答.
(5)①G为Cu,位于周期表中第四周期ⅠB族,为ds区;
②利用均摊法计算得出;计算出一个晶胞中微粒数,利用化合物的摩尔质量和密度计算出晶胞边长,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体体对角线的$\frac{1}{4}$.
解答 解:A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,则A为H元素;化合物CD2为红棕色气体,该气体为NO2,则C为N、D为O元素;B原子最外层有两个未成对电子,其原子序数小于N,则B为C元素;E的单质易与水反应且只作氧化剂,则E为F元素;元素F基态原子的3p轨道上有5个电子,则F含有3个电子层,最外层含有7个电子,为Cl元素;G是第四周期元素,最外层只有一个电子,其余各层电子均充满,核外电子数=2+8+18+1=29,则G为Cu元素,
(1)B、C、D分别为C、N、O,同周期,随原子序数增大元素第一电离能呈增大趋势,但氮元素2p能级为半满稳定状态,能量较低,失去第一个电子需要的能量较多,其第一电离能高于同周期相邻元素,故C、N、O三种元素的第一电离能数值从大到小的顺序为:N>O>C,
故答案为:N>O>C;
(2)H、C、O可形成分子式为H2CO,为HCHO,该分子中C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断C原子杂化方式为sp2,
故答案为:sp2;
(3)E的单质为F2,F2与水反应生成氟化氢和氧气,反应的化学方程式为:2H2O+2F2=4HF+O2↑,
故答案为:2H2O+2F2=4HF+O2↑;
(4)元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素,
①X、为Zn、Y为S,X与Y所形成化合物中X的化合价等于其族序数,则X的化合价为+2,Y达到8电子的稳定结构,该化合物为ZnS,
故答案为:ZnS;
②D为O、Y为S,D的氢化物为H2O,H2Y为H2S,在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大,而H2S分子与水分子之间不形成氢键,
故答案为:乙醇分子与水分子之间形成氢键而H2S分子与水分子之间不形成氢键;
③该配合物为[Zn(NH3)4]Cl2,高配合物的配离子中Zn原子和N原子、氨气分子中N原子和H原子之间都存在σ键,则一个该配离子中σ键个数=4+3×4=12,所以配合物[Zn(NH3)4]Cl2中含有σ键的数目为16,
故答案为:16;
(5)①F为Cl、G为Cu,Cu位于周期表中第四周期ⅠB族,属于ds区,
故答案为:ds;
②由铜与Cl形成化合物的晶胞可知,4个铜原子都在晶胞内部,故该晶胞中铜的个数为4,氯原子的个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以该晶体的化学式为:CuCl;
将大正方体分成8个小正方体,则该晶体中铜原子和M原子之间的最短距离为小正方体的体对角线的一半,1个该晶体中含有4个CuCl,则该晶体的体积为:$\frac{4×99.5}{ρ{N}_{A}}$cm3,晶胞的边长为$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,小正方体的边长为$\frac{1}{2}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,小正方体的体对角线是小正方体边长的$\sqrt{3}$倍,则小正方体的体对角线为:$\frac{\sqrt{3}}{2}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,则该晶体中铜原子和Cl原子之间的最短距离为:$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$cm,
故答案为:CuCl;$\frac{\sqrt{3}}{4}$$\root{3}{\frac{4×99.5}{ρ{N}_{A}}}$.
点评 本题考查较为综合,涉及晶胞计算、元素推断、氢键、原子结构与元素周期表、元素周期律的关系等知识,题目难度较大,推断元素为解答关键,(5)为易错点,注意掌握均摊法在晶胞计算中的应用,试题培养了学生的分析、理解能力及逻辑推理能力.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案| A. | 合金的性能一般优于纯金属 | |
| B. | 碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀 | |
| C. | 酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜 | |
| D. | 用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强 |
| A. | 丙烯、环己烯 | B. | 乙酸和甲酸甲酯 | ||
| C. | 对甲苯酚和苯甲醇 | D. | 甲醛和甲酸甲酯 |
| A. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| C. | 铝与硫酸铜溶液反应:Al+Cu2+═Al3++Cu | |
| D. | 氯化钡溶液与稀硫酸反应:SO42-+Ba2+═BaSO4↓ |
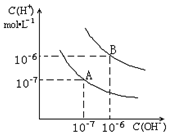 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: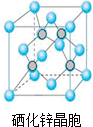 (1)基态硒原子的价层电子排布式为4s24p4.
(1)基态硒原子的价层电子排布式为4s24p4.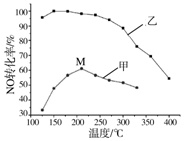 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0