题目内容
某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液.检验其中OH-的实验方法从略,检验其他阴离子的过程如图所示.
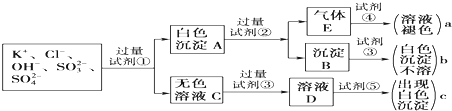
(1)图中试剂①~④溶质的化学式分别是:① ,② ,③ ,④ .
(2)白色沉淀A加试剂②反应的离子方程式是
(3)无色溶液C加试剂③的主要目的是 .
(4)气体E通入试剂④发生反应的离子方程式是 .

(1)图中试剂①~④溶质的化学式分别是:①
(2)白色沉淀A加试剂②反应的离子方程式是
(3)无色溶液C加试剂③的主要目的是
(4)气体E通入试剂④发生反应的离子方程式是
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:SO32-、SO42-与Ba(NO3)2溶液反应分别生成亚硫酸钡和硫酸钡白色沉淀,亚硫酸钡与盐酸反应生成二氧化硫气体,二氧化硫能使溴水褪色,故试剂①为Ba(NO3)2溶液,试剂②为盐酸,试剂④为溴水;无色溶液C呈碱性,加入过量硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,根据以上分析可知溶液中含有Cl-、SO32-、SO42-.
解答:
解:(1)SO32-、SO42-与Ba(NO3)2溶液反应分别生成亚硫酸钡和硫酸钡白色沉淀,亚硫酸钡与盐酸反应生成二氧化硫气体,二氧化硫气体E能使溴水褪色,硫酸钡不溶解于硝酸中,故试剂①为Ba(NO3)2溶液,试剂②为盐酸或硝酸,试剂④为溴水,无色溶液C呈碱性,加入过量试剂③硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,
故答案为:Ba(NO3)2;HCl;HNO3;Br2;
(2)亚硫酸钡可以和强酸反应生成可溶性的钡盐和水以及二氧化硫,即BaSO3+2H+═Ba2++SO2↑+H2O,
故答案为:BaSO3+2H+═Ba2++SO2↑+H2O;
(3)无色溶液A中含有OH-,OH-和硝酸银反应生成氧化银黑色沉淀,干扰对Cl-的检验,所以加入过量稀硝酸,中和OH-,防止对Cl-的检验产生干扰,
故答案为:中和OH-,防止对Cl-的检验产生干扰;
(4)溴单质与二氧化硫反应生成氢溴酸和硫酸,离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-,故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-.
故答案为:Ba(NO3)2;HCl;HNO3;Br2;
(2)亚硫酸钡可以和强酸反应生成可溶性的钡盐和水以及二氧化硫,即BaSO3+2H+═Ba2++SO2↑+H2O,
故答案为:BaSO3+2H+═Ba2++SO2↑+H2O;
(3)无色溶液A中含有OH-,OH-和硝酸银反应生成氧化银黑色沉淀,干扰对Cl-的检验,所以加入过量稀硝酸,中和OH-,防止对Cl-的检验产生干扰,
故答案为:中和OH-,防止对Cl-的检验产生干扰;
(4)溴单质与二氧化硫反应生成氢溴酸和硫酸,离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-,故答案为:Br2+SO2+2H2O=4H++SO42-+2Br-.
点评:本题考查无机框图题,考查了常见离子的检验,试题涉及物质的推断、离子的性质及检验方法、化学方程式的书写等知识,根据反应现象推断各物质的成分是解题的关键,题目难度中等.

练习册系列答案
相关题目
下列关于胶体的说法错误的是( )
| A、胶体的分散质不能透过滤纸 |
| B、胶体是混合物 |
| C、胶体具有丁达尔效应 |
| D、胶体分散质粒子大小在1-100nm之间 |
下列各种元素形成的单质氧化性最强的是( )
| A、原子含有未成对电子最多的第二周期元素 |
| B、位于周期表中第三周期ⅢA族的元素 |
| C、原子最外层电子排布为3s23p3的元素 |
| D、原子最外层电子排布为2s22p4的元素 |
与100mL 0.1mol/LK2SO4溶液中K+离子浓度相同的是( )
| A、10mL 1mol/L K2SO4溶液 |
| B、50mL 0.2mol/LKCl溶液 |
| C、10mL 0.2mol/LK2SO4溶液 |
| D、200mL 0.1mol/L KNO3溶液 |
 烃及烃的含氧衍生物在有机化学中占有举足轻重的地位.请根据相关知识和信息回答下列有关问题:
烃及烃的含氧衍生物在有机化学中占有举足轻重的地位.请根据相关知识和信息回答下列有关问题:
 电解原理在工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: