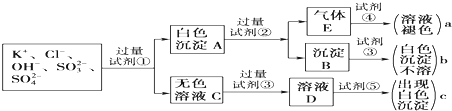
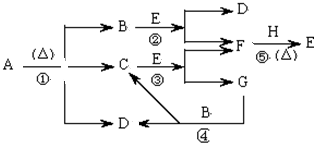
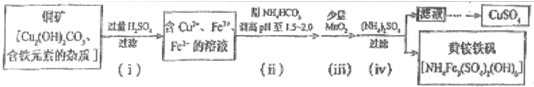
题目内容
N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和液态水时,放出150.0kJ热量.写出该反应的热化学方程式: .
考点:热化学方程式
专题:化学反应中的能量变化
分析:根据热化学方程式的意义以及热化学方程式的书写方法来写.
解答:
解:0.25mol N2H4(g)完全燃烧生成氮气和液态水时,放出150.0kJ热量,则1mol N2H4(g)完全燃烧生成氮气和液态水时,放出150.0kJ×4=600kJ的热量,热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-600kJ?mol-1;
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-600kJ?mol-1;
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-600kJ?mol-1;
点评:本题考查了热化学方程式书写方法,注意物质聚集状态和对应反应焓变的计算,掌握基础是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验操作不正确的是( )
| A、分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、过滤时,玻璃棒在引流过程中应轻靠在三层滤纸一边 |
| D、称量时,称量物放在纸上,置于左盘,砝码放在右盘 |
下列说法正确的是( )
| A、标准状况下,11.2LHCl中含 6.02×1023个离子 |
| B、△H<0,△S>0的化学反应一定能自发进行 |
| C、pH=5的盐酸,稀释1000倍后,溶液pH约为8 |
| D、NaHA溶液PH>7,则c(Na+)=c(HA-)+c(H2A)+2c(A2-) |