题目内容
把Cl2通入含11g NaBr的溶液中,充分反应后将溶液蒸干,得6.55g残渣,计算:
(1)生成的NaCl为多少克?
(2)将残渣溶于水配成溶液,向所得溶液中滴加足量的硝酸银溶液,充分反应后所得白色沉淀质量为多少克?
(1)生成的NaCl为多少克?
(2)将残渣溶于水配成溶液,向所得溶液中滴加足量的硝酸银溶液,充分反应后所得白色沉淀质量为多少克?
考点:氯、溴、碘及其化合物的综合应用,化学方程式的有关计算
专题:计算题,卤族元素
分析:(1)向含有NaBr的溶液中通入过量的Cl2,发生:2NaBr+Cl2=2NaCl+Br2,根据固体质量差量法来计算;
(2)氯化钠和硝酸银之间反应生成氯化银沉淀和硝酸钠,根据氯元素守恒来计算氯化银的质量.
(2)氯化钠和硝酸银之间反应生成氯化银沉淀和硝酸钠,根据氯元素守恒来计算氯化银的质量.
解答:
解:(1)向含有NaBr的溶液中通入过量的Cl2,发生:2NaBr+Cl2=2NaCl+Br2,设生成的NaCl的质量为x,
2NaBr+Cl2=2NaCl+Br2 固体质量变化
206 58.5×2 89
11 xg 11g-6.55g
×2=
,解得x=5.85g,
答:生成的NaCl为5.85克;
(2)将残渣溶于水配成溶液,向所得溶液中滴加足量的硝酸银溶液,根据NaCl~AgCl↓,则NaCl为5.85克得到氯化银的质量是
=14.35(g)
答:充分反应后所得白色沉淀质量为14.35克.
2NaBr+Cl2=2NaCl+Br2 固体质量变化
206 58.5×2 89
11 xg 11g-6.55g
| 58.5 |
| x |
| 89 |
| 11-6.55 |
答:生成的NaCl为5.85克;
(2)将残渣溶于水配成溶液,向所得溶液中滴加足量的硝酸银溶液,根据NaCl~AgCl↓,则NaCl为5.85克得到氯化银的质量是
| 143.5×5.85 |
| 58.5 |
答:充分反应后所得白色沉淀质量为14.35克.
点评:本题考查学生氯气的性质以及元素守恒思想的应用,注意化学知识在解题中的灵活应用是关键,难度不大.

练习册系列答案
相关题目
 2008年诺贝尔化学奖授予了钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白质(简称GFP)方面做出的卓越贡献.生色团是GFP发出荧光的物质基础,也是GFP结构中的一个重要组成部分,多管水母中GFP生色团的化学结构如图,下列说法正确的是( )
2008年诺贝尔化学奖授予了钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白质(简称GFP)方面做出的卓越贡献.生色团是GFP发出荧光的物质基础,也是GFP结构中的一个重要组成部分,多管水母中GFP生色团的化学结构如图,下列说法正确的是( )| A、该生色团不与NaHCO3反应 |
| B、该生色团分子式C30H37N8O9 |
| C、该生色团可以水解得到5种有机物 |
| D、该生色团中的肽键数为3 |
化学与生产、生活密切相关.下列叙述中,不正确的是( )
| A、制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO |
| B、二氧化碳和氮气均是造成温室效应的气体 |
| C、食醋可去除水垢,NH4Cl溶液可去除铁锈 |
| D、SO2和NO2都能使雨水的pH<5.6,造成酸雨 |
研究性学习小组为了证明铁的金属性比铜强,他设计了如下几种方案,其中合理的是 ( )
| A、铁片置于硫酸铜溶液中有铜析出 |
| B、铁、铜与氯气反应分别生成FeCl3、CuCl2 |
| C、铜片置于FeCl3溶液中,铜片逐渐溶解(2FeCl3+Cu=2FeCl2+CuCl2) |
| D、铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片无气泡 |
| E、常温下,分别将铁片和铜片置于浓硝酸中,铁片不溶解,而铜片溶解 |
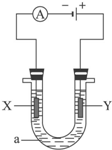 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
 和
和 