题目内容
 电解原理在工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若X、Y是惰性电极,a是200mLNaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是
考点:电解原理
专题:电化学专题
分析:(1)电解饱和氯化钠溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子离子失电子,阴极上是氢离子得电子;
(2)根据电解精炼铜的工作原理知识来回答.
(2)根据电解精炼铜的工作原理知识来回答.
解答:
解:(1)和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,X电极负极水的电离被破坏,氢氧根离子浓度增大,溶液呈红色,阴极附近有气泡冒出;和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,检验氯气的方法是用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;
当外电路通过0.02mol电子时,充分混合电解后的溶液,忽略溶液体积变化,阴极电极反应可知反应过程中消耗氢离子物质的量和生成氢氧根离子物质的量相同为0.02mol,溶液中c(OH-)=
=0.1mol/L;
c(H+)=
=10-13mol/L;
溶液pH=13;
故答案为:2H++2e-=H2↑;有气泡生成,溶液呈红色;2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;13;
(2)电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,
故答案为:纯铜;粗铜;Cu-2e-=Cu2+.
当外电路通过0.02mol电子时,充分混合电解后的溶液,忽略溶液体积变化,阴极电极反应可知反应过程中消耗氢离子物质的量和生成氢氧根离子物质的量相同为0.02mol,溶液中c(OH-)=
| 0.02mol |
| 0.2L |
c(H+)=
| 10-14 |
| 0.1 |
溶液pH=13;
故答案为:2H++2e-=H2↑;有气泡生成,溶液呈红色;2Cl--2e-=Cl2↑;用湿润的淀粉碘化钾试纸检验生成的气体,气体能使试纸变蓝色;13;
(2)电解方法精炼粗铜,X为阴极,电解池的阴极材料是纯铜,电极反应为Cu2++2e-=Cu,Y为阳极,电解池的阳极材料是粗铜,电极反应为:Cu-2e-=Cu2+,
故答案为:纯铜;粗铜;Cu-2e-=Cu2+.
点评:本题考查学生电解池的工作原理知识,明确图中电源的正负极确定电解池的阴阳极是解答的关键,并熟悉电极反应及离子的放电顺序来解答,题目难度中等.

练习册系列答案
相关题目
下列化学反应能用离子方程式H++OH-═H2O表示的是( )
| A、硫酸氢钠溶液与氢氧化钾溶液反应 |
| B、稀硫酸与氢氧化钡溶液反应 |
| C、稀硝酸与氢氧化铜反应 |
| D、醋酸与氢氧化钠溶液反应 |
下列说法正确的是( )
| A、标准状况下,11.2LHCl中含 6.02×1023个离子 |
| B、△H<0,△S>0的化学反应一定能自发进行 |
| C、pH=5的盐酸,稀释1000倍后,溶液pH约为8 |
| D、NaHA溶液PH>7,则c(Na+)=c(HA-)+c(H2A)+2c(A2-) |
决定化学反应的主要因素是( )
| A、温度 | B、压强 |
| C、浓度 | D、反应物本身的性质 |
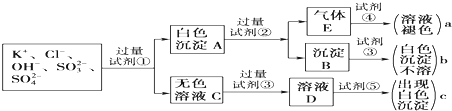
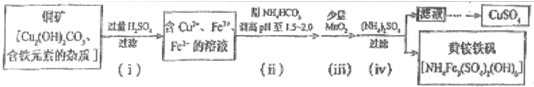
 (系统命名)
(系统命名)
 和
和 