题目内容
18.SOCl2是一种液态化合物,沸点为77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10 滴SOCl2,发生剧烈反应,液面上有白雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色.轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出.(1)则SOCl2和水反应的化学方程式为:SOCl2+H2O=2HCl↑+SO2↑.
(2)将FeCl3溶液直接蒸干得不到无水FeCl3,而得到Fe(OH)3(填化学式).若用SOCl2与FeCl3•6H2O混合共热,则可得到无水FeCl3,其原因是SOCl2消耗FeCl3•6H2O中的结晶水,并产生HCl,抑制FeCl3的水解.
分析 (1)液面上有大量白雾,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于稀HNO3的凝乳状白色沉淀产生,说明白雾为盐酸的小液滴,即会产生HCl;同时有带刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色说明是SO2;
(2)用SOCl2与FeCl3•6H2O混合共热,可得无水FeCl3,是因SOCl2与水反应既减少可水的量,生成的HCl又抑制了FeCl3的水解.
解答 解:(1)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,该两种气体应该为氯化氢和二氧化硫,反应的方程式为SOCl2+H2O=2HCl↑+SO2↑,故答案为:SOCl2+H2O=2HCl↑+SO2↑;
(2)将FeCl3溶液直接蒸干得不到无水FeCl3,原因是氯化铁水解出的HCl是挥发性酸,HCl的挥发导致氯化铁的水解被促进,故蒸干后得Fe(OH)3;SOCl2与水反应生成的氯化氢会对氯化铁水解起到抑制作用;反应的化学方程式为:SOCl2+H2O=2HCl↑+SO2↑,蒸干FeCl3溶液不能得到无水FeCl3,使SOCl2与FeCl3•6H20混合并加热,可得到无水FeCl3,SOCl2与水反应生成的氯化氢会对氯化铁水解起到抑制作用,
故答案为:Fe(OH)3;SOCl2消耗FeCl3•6H2O 中的结晶水,并产生HCl,抑制FeCl3的水解.
点评 本题考查了元素化合物的性质,为高频考点,侧重于学生的分析能力的考查,难度不大,能正确判断SOCl2和水反应的生成物是解本题的关键.

练习册系列答案
相关题目
8.短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断不正确的是( )
| A. | 最外层电子数:Z>R>Y | |
| B. | 气态氢化物的稳定性:Y<Z | |
| C. | R、X的氧化物均为离子化合物 | |
| D. | X和Y两者最高价氧化物对应的水化物能相互反应 |
9.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 铝离子结构示意图: | ||
| C. | 甲烷分子的球棍模型: | D. | 醛基的电子式: |
6.下列对实验室中试剂储存的有关说法不正确的是( )
| A. | 金属钠存放在试剂瓶中的煤油里 | |
| B. | 存放液溴的试剂瓶中应加水封 | |
| C. | 硝酸应用棕色瓶盛装且避光存放 | |
| D. | 烧碱应盛放在玻璃塞的磨口玻璃瓶中 |
3.近年来AIST报告正在研制一种“高容量、低成本”锂一铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

| A. | 通空气时,铜被腐蚀,表面产生CuO | |
| B. | 放电时,Li+透过固体电解质向Cu极移动 | |
| C. | 放电时,正极的电极反应式为Cu2O+H2O+2e-═2Cu+2OH- | |
| D. | 整个反应过程中,铜相当于催化剂 |
10.实验室中需用3mol/L 的K2CO3溶液480mL,配置时应选用的容量瓶的规格和称取K2CO3的质量分别为( )
| A. | 1000 mL,514.00 g | B. | 480 mL,198.72 g | ||
| C. | 500 mL,207.00 g | D. | 任意规格,207.00 g |
7. 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
根据表中数据计算:
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
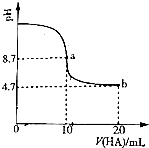
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
 合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,
合成氨工业对国民经济和社会发展具有重要的意义,其原理是:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,(1)已知合成氨反应在某温度下2L的密闭容器中进行,测得数据如表:
| 不同时间各物质的物质的量/mol | |||||
| 0min | 1min | 2min | 3min | 4min | |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0 min~1 min内N2的平均反应速率为0.05mol/(L•min)
②该条件下反应的平衡常数k=0.15(保留两位小数)
③反应达到平衡后,若往平衡体系中再加入N2、H2、NH3各1mol,化学平衡向正向(填“正向”、“逆向”或“不移动”),该反应的平衡常数k不变(填“变大”“减小”或“不变”)
④能表明该反应达到平衡状态的是B(选填序号)
A.N2的转化率等于NH3的产率 B.混合气体的平均相对分子质量不变
C.v(N2)与v(H2)的比值不变 D.混合气体的密度不变
(2)室温下向10mL0.3mol/LNaOH溶液中加入0.3mol/L的一元酸HA溶液pH的变化曲线如图,下列说法正确的是CE.
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.pH=7时,c(Na+)=c(A-)+c(HA)
E.b点所示溶液中c(HA)+c(A-)=0.2mol/L.
8.晶体硅是一种重要的非金属材料,模拟制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
③SiHCl3与过量H2在1000~1100℃反应制得纯硅可能用到的信息如下:
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
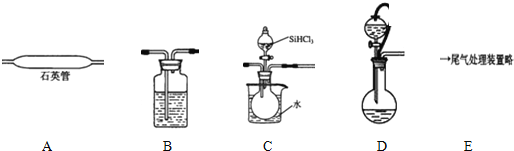
①依次连接的合理顺序为DBCAE;装置D中g管的作用是平衡压强;装置B中的试剂是浓硫酸;装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl$\frac{\underline{\;300℃\;}}{\;}$SiHCl3+H2,
| 沸点/℃ | |
| SiHCl3 | 33.0 |
| SiCl4 | 57.6 |
| HCl | -84 |
已知SiHCl3能与H2O强烈反应,在空气中易自燃;
步骤②中粗硅与HCl反应时会生成少量SiCl4;
请回答下列问题:
(1)粗硅与HCl反应完全后,依据上表所示沸点差异提纯SiHCl3.该提纯方法为分馏.
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):

①依次连接的合理顺序为DBCAE;装置D中g管的作用是平衡压强;装置B中的试剂是浓硫酸;装置C中的烧瓶加热的目的是使滴入烧瓶中的SiHCl3气化.
②装置A中发生反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
③操作时应先打开装置D(C或D)中分液漏斗的旋塞,理由是:因为SiHCl3容易在空气自燃,实验中还要注意先通一段时间H2排尽装置中的空气.
(3)请设计实验证明产品硅中是否含微量铁单质:将产品用稀盐酸溶解,取上层清液后先滴加氯水,再滴加硫氰化钾溶液,溶液显红色.
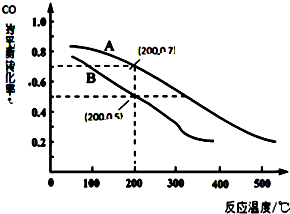 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有: