题目内容
9.下列反应最终无沉淀产生的是( )| A. | 过量的CO2通入Na2SiO3溶液中 | |
| B. | 向AlCl3溶液中滴加稀氨水至过量 | |
| C. | 少量的CO2通入BaCl2溶液中 | |
| D. | 向FeCl3溶液中滴加NaOH溶液至过量 |
分析 A.过量的CO2通入Na2SiO3溶液可生成硅酸;
B.氢氧化铝不溶于氨水;
C.二氧化碳与氯化钡不反应;
D.向FeCl3溶液中滴加NaOH溶液至过量,生成氢氧化铁沉淀.
解答 解:A.硅酸酸性比碳酸弱,过量的CO2通入Na2SiO3溶液可生成硅酸,故A不选;
B.氢氧化铝不溶于氨水,向AlCl3溶液中滴加稀氨水至过量,可生成氢氧化铝沉淀,故B不选;
C.碳酸酸性比盐酸弱,二氧化碳与氯化钡不反应,故C选;
D.向FeCl3溶液中滴加NaOH溶液至过量,生成氢氧化铁沉淀,故D不选.
故选C.
点评 本题综合考查元素化合物知识,为高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
19.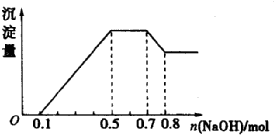 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种,若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入的物质的量之间的关系如图所示,下列说法正确的是( )| A. | 溶液中一定不含有CO32-,可能含有SO42-和NO3- | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | C.溶液中的阳离子只有H+、Mg2+、Al3+ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
20.下列物质中,既含有离子键又含有共价键的是( )
| A. | KOH | B. | LiCl | C. | H2 | D. | NH3 |
17.下列离子方程式正确的是( )
| A. | 浓烧碱溶液中加入铝片:Al+2OH-═AlO2-+H2↑ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,使SO42-全部沉淀:2Al3++6OH-+3SO42-+3Ba2+=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在2 mol/L FeBr2溶液80 mL中通入4.48 L氯气(标况下),充分反应:4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |