题目内容
11.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各离子不重复):阳离子:H+、Na+、Al3+、Ag+、Ba2+
阴离子:OH-、Cl-、CO32-、NO3-、SO42-
已知:①A、B两溶液呈碱性,C、D、E溶液呈酸性.
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失.
③D溶液与另外四种溶液反应都能产生沉淀.
请回答下列问题:
(1)写出B、D、E的化学式:BBa(OH)2,DAgNO3,EAl2(SO4)3.
(2)写出A与E溶液反应的离子方程式:2Al3++3CO32-+3H2O═3CO2↑+2Al(OH)3↓.
(3)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中至反应完全,离子方程式为:H++CO32-=HCO3-
(4)在100mL 0.1mol•L-1 E溶液中,逐滴加入40mL 1.6mol•L-1NaOH溶液,最终得到沉淀物 质的量为0.016mol.
分析 由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,在所有的阳离子和阴离子组成的物质中,只有硫酸铝和氢氧化钡反应沉淀量先增加后减少但不消失,所以E是硫酸铝,B是氢氧化钡;
在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、碳酸钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,A为碳酸钠、C是盐酸;
综上所述,A、B、C、D、E分别为:Na2CO3、Ba(OH)2、HCl、AgNO3、Al2(SO4)3,以此来解答.
解答 解:(1)由以上分析可知B为Ba(OH)2,D为AgNO3,E为Al2(SO4)3,故答案为:Ba(OH)2;AgNO3;Al2(SO4)3;
(2)A、E发生相互促进水解反应,离子反应为2Al3++3CO32-+3H2O═3CO2↑+2Al(OH)3↓,
故答案为:2Al3++3CO32-+3H2O═3CO2↑+2Al(OH)3↓;
(3)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中至反应完全生成碳酸氢钠和氯化钠,反应的离子方程式为H++CO32-=HCO3-,
故答案为:H++CO32-=HCO3-;
(4)n(Al2(SO4)3)=0.1L×0.1mol/L=0.01mol,n(Al3+)=0.02mol,n(NaOH)=0.04L×1.6mol/L=0.064mol,首先发生Al3++3OH-=Al(OH)3↓,此时消耗0.06molOH-,继续发生Al(OH)3+OH-=AlO2-+2H2O,反应消耗NaOH的物质的量为0.064mol-0.060mol=0.004mol,则剩余n(Al(OH)3)=0.02mol-0.004mol=0.016mol,
故答案为:0.016.
点评 本题考查离子的推断和无机物的推断,为高频考点,把握离子之间的反应、盐类水解等推断物质为解答的关键,侧重化学反应原理的考查,综合性较强,题目难度中等.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案| A. | [AgCl2]- | B. | [Ag(NH3)2]+ | C. | [Ag(S2O3)2]3- | D. | [Ag(CN)2]- |
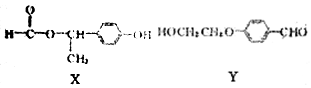
| A. | 物质X中只含1个手性碳原子 | |
| B. | FeCl3溶液和银氨溶液均可鉴别X和Y | |
| C. | 物质Y在NaOH醇溶液中能发生消去反应 | |
| D. | 1molX与NaOH溶液反应,最多消耗NaOH的物质的量为1mol |
| A. | 标准状况下,22.4LSO3含有的分子数为NA | |
| B. | 常温常压下,7.8gNa2O2含有的阴离子数目为0.2NA | |
| C. | 将含lmol FeCl3的溶液制得的Fe(OH)3胶体中含胶粒数为NA(假设所有的FeCl3都转化为Fe(OH)3胶体) | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA |
Y极:4H2O+2O2+8e-═8OH-
关于此燃料电池的说法,错误的是( )
| A. | X极为负极,Y极为正极 | |
| B. | 在标准状况下通入5.6LO2完全反应,则有0.5mol电子发生转移 | |
| C. | 工作一段时间后,KOH的物质的量减小 | |
| D. | 该电池工作时甲烷一极附近溶液pH下降 |
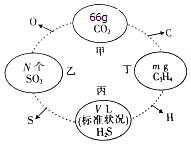 如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)
如图,两相邻圆圈内物质间含有相同的某一原子,且该原子的物质的量相同.(设NA为阿伏伽德罗常数的值)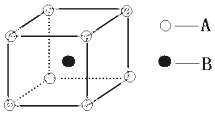 根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).
根据离子晶体的晶胞结构,判断下列离子晶体的化学式:AB(A表示阳离子,B表示阴离子).