题目内容
5.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 11gT2O含有的电子数为5NA | |
| B. | 常温下,0.2L 0.5mol•L-1NH4NO3溶液的氮原子数小于0.2NA | |
| C. | 含4molHCl的浓盐酸与足量二氧化锰反应转移的电子总数为NA | |
| D. | 标准状况下,2.24L H2S全部溶于水所得溶液中HS-和S2-离子激之和为0.1NA |
分析 A、求出超重水的物质的量,然后根据超重水中含10个电子来分析;
B、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2mol氮原子来分析;
C、二氧化锰只能和浓盐酸反应,和稀盐酸不反应;
D、H2S为弱酸,在溶液中不能完全电离.
解答 解:A、11g超重水的物质的量为0.5mol,而超重水中含10个电子,故0.5mol中含5NA个电子,故A正确;
B、溶液中硝酸铵的物质的量n=0.5mol/L×0.2L=0.1mol,而1mol硝酸铵中含2mol氮原子,故溶液中含有的氮原子个数为0.2NA个,故B错误;
C、二氧化锰只能和浓盐酸反应,和稀盐酸不反应,故当盐酸变稀时反应即停止,故盐酸不能反应完全,则转移的电子总数小于NA个,故C错误;
D、H2S为弱酸,在溶液中不能完全电离,故溶液中的H2S、HS-和S2-的个数之和为0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.下列能产生丁达尔现象的是( )
| A. | 氯化钠溶液 | B. | 氢氧化铁胶体 | C. | 盐酸 | D. | 硫酸铜溶液 |
17.在芳香族化合物中,由于侧链与苯环间的相互影响,从而使它们在性质上都发生了一些变化.下列反应中能够说明这一现象的是( )
| A. |  | |
| B. | 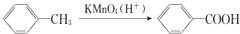 | |
| C. | 甲苯和乙烷在空气中完全燃烧,生成相同的产物 | |
| D. | 甲苯和乙烷都不能与溴的四氯化碳溶液发生反应 |
 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1. 按要求填空:
按要求填空: ;
; ;
;