题目内容
5.将溶质的质量分数为10%的KOH溶液加热蒸发掉100g水后,得到溶质的质量分数为35%的溶液50mL,此时溶液的物质的量浓度为( )| A. | 5mol•L-1 | B. | 3.25mol•L-1 | C. | 7mol•L-1 | D. | 6.25mol•L-1 |
分析 设10%KOH溶液的质量为m,根据溶质质量不变列方程计算溶液的质量,进而计算溶质的物质的量,根据c=$\frac{n}{V}$计算.
解答 解:设10%KOH溶液的质量为m,则:
m×10%=(m-100g)×35%,
解得m=140g,
m(KOH)=140g×10%=14g,
n(KOH)=$\frac{14g}{56g/mol}$=0.25mol,
c(KOH)=$\frac{0.25mol}{0.05L}$=5mol/L,
故选A.
点评 本题考查溶液浓度计算,涉及质量分数、物质的量浓度,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.有关图的说法不正确的是( )
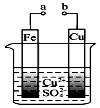

| A. | 构成原电池时Cu极反应为:Cu2++2e-=Cu | |
| B. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| C. | 要使Fe极不被腐蚀,Cu片换Zn片或将a与直流电源的负极相连 | |
| D. | a和b分别连接直流电源正、负极,Fe片上有气体产生 |
16.下列说法正确的是( )
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 胆矾、冰水混合物、四氧化三铁都不是混合物 | |
| C. | 分离胶体和某盐溶液,可用过滤的方法 | |
| D. | SO2、SiO2、CO均为酸性氧化物 |
13.下列有关化学用语表示正确的是( )
| A. | 乙醇的分子式:C2H5OH | B. | C的基态原子核外电子轨道表示式: | ||
| C. | 氯化铵的电子式: | D. | CS2分子比例(填充)模型: |
10.苹果切开不久,果肉上便会产生一层咖啡色的物质,其原因是果肉里的酚在空气中被氧化为有色物质,这些有色物质很快聚合成为咖啡色的聚合物.则这种空气中常见的氧化剂可能是( )
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
14.在一密闭容器中发生反应:2X(g)+Y(g)?aZ(g)△H=QkJ•mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应.图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )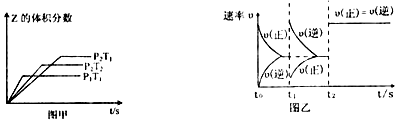

| A. | 图甲,P1>P2,a<3 | |
| B. | 图甲,T1<T2,Q>0 | |
| C. | 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体 | |
| D. | 图乙,如果a=3,t2时表示向体系中加入了催化剂 |
15.下列说法不正确的是( )
| A. | 氢氧化铁胶体可用于净水 | B. | 水玻璃用于建筑黏合剂 | ||
| C. | 纯碱溶液用于去除油污 | D. | MnO2和浓HCl用于工业制氯气 |