题目内容
18.乙醇燃料电池是一种绿色的生物燃料电池.其工作原理如图所示.下列有关说法不正确的是( )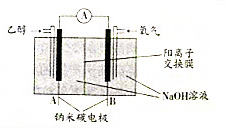
| A. | A极为电池负极,B极为电池正极 | |
| B. | B极的电极反应式为O2+2H2O+4e-═4OH- | |
| C. | 该乙醇燃料电池的总反应方程式为:C2H5OH+3O2═2CO2+3H2O | |
| D. | 当电池消耗4.6g乙醇时,经过阴离子交换膜的OH-为1.2mol |
分析 A.燃料在负极失电子,氧气在正极得电子;
B.正极上氧气得电子生成氢氧根离子;
C.碱性条件下,二氧化碳转化为碳酸根离子;
D.阴离子不能透过阳离子交换膜.
解答 解:A.燃料在负极失电子,则通入乙醇的一极为负极,即A为负极,B为正极,故A正确;
B.正极上氧气得电子生成氢氧根离子,则B极的电极反应式为O2+2H2O+4e-═4OH-,故B正确;
C.碱性条件下,二氧化碳转化为碳酸根离子,所以该乙醇燃料电池的总反应方程式为:C2H5OH+3O2+4OH-=2CO32-+5H2O,故C错误;
D.阴离子不能透过阳离子交换膜,所以OH-不能通过阳离子交换膜,故D错误;
故选CD.
点评 本题考查化学电源新型电池,为高频考点,根据得失电子判断正负极,再结合原电池概念、电子流向分析解答即可,题目难度不大.

练习册系列答案
相关题目
8.向30mL 1mol•L-1的AlCl3溶液中逐渐加入浓度为4mol•L-1的NaOH溶液,若产生0.78g白色沉淀,则加入的NaOH溶液的体积可能为( )
| A. | 3 mL | B. | 7.5 mL | C. | 15 mL | D. | 22.5 mL |
3.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | c(OH-)/c(H+)=10-12的溶液中:K+、Ba2+、Br-、Cl- | |
| B. | 0.1mol•Lˉ1NaHC2O4溶液中:K+、Ba2+、OH-、Cl- | |
| C. | pH=7的溶液中:Fe3+、Na+、Cl-、NO3- | |
| D. | 含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
3.1996年2月,德国达姆斯特重离子研究所合成出当时最重要的人造元素,它是由${\;}_{30}^{70}$Zn撞入一个${\;}_{82}^{208}$Pb的原子核,并立即释放出一个中子而产生的一种新元素的原子.该元素的原子核内所含有的质子数是( )
| A. | 111 | B. | 112 | C. | 113 | D. | 114 |
20.下列操作中的试剂、方法和对应原理都正确的是( )
| 选项 | 目的 | 试剂与方法 | 原理 |
| A | 灭火 | 混合Al2(SO4)3与NaHCO3两种溶液 | 两物质直接发生化学反应产生CO2 |
| B | 制备胆矾 | 将CuSO4溶液加热直至蒸干 | 加热促进Cu2+的水解 |
| C | 配制AlCl3溶液 | AlCl3溶液中加硫酸 | 抑制Al3+水解 |
| D | 除铁锈 | NH4Cl溶液 | NH4Cl溶液显酸性 |
| A. | A | B. | B | C. | C | D. | D |
1.下列各项内容中排列顺序正确的是( )
| A. | 相同物质的量浓度的下列溶液中NH4+的浓度:(NH4)2SO4>NH4Cl>NH4HCO3 | |
| B. | 微粒半径:K+>S2->F- | |
| C. | 给出质子的能力:CH3COOH>C2H5OH>H2O | |
| D. | 氢化物的沸点:HF>HCl>HBr |