题目内容
14.下列关于物质的制备、性质、收集说法正确的是( )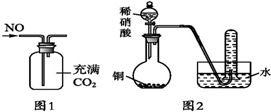
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
分析 A.氮气和氧气在放电条件下生成NO,一氧化氮和氧气反应生成二氧化氮;
B.NO的密度比二氧化碳小;
C.NO2与水反应会生成硝酸和NO;
D.溴单质可以将碘离子氧化为碘单质,但是NO2与水反应会生成硝酸,硝酸也可以将碘离子氧化为碘单质;
解答 解:A.氮气和氧气在放电条件下生成NOx气体,故A正确;
B.NO的密度比二氧化碳小,所以应该从短管进入,故B错误;
C.如果含有NO2,NO2与水反应会生成硝酸和NO,所以无法排除NO2的干扰,故C错误;
D.溴单质可以将碘离子氧化为碘单质,但是NO2与水反应会生成硝酸,硝酸也可以将碘离子氧化为碘单质,所以,不能用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气,故D错误.
故选A.
点评 本题考查汽车尾气NOx的产生原理、NO的制备和收集、NO2、Br2的鉴别等化学性质的知识,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
18.NH4Cl溶液中,下列叙述正确的是( )
| A. | c(NH4+)>c(Cl-)>c(OH-)>c( H+) | B. | c(Cl-)>c(NH4+)>c( H+)>c(OH-) | ||
| C. | c(NH4+)+c( NH3)=c(Cl-)+c(OH-) | D. | c(NH4+)+c( NH3•H2O)+c( NH3)=c(Cl-) |
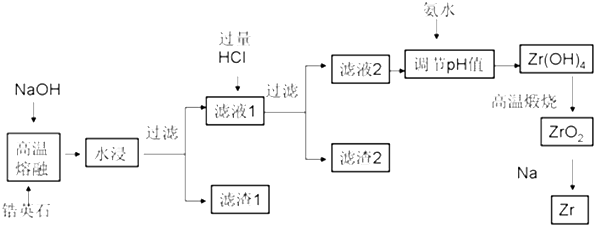
19.锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷.我国有丰富的锆英石(ZrSiO4)含Al2O3、SiO2、Fe2O3等杂质,碱熔法生产锆的流程如下:
已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
(1)完成高温熔融时的主要反应方程式:
ZrSiO4+4NaOH═Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3或H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发浓缩、冷却结晶、过滤,可回收得到铁的氯化物FeCl3晶体.

已知25℃时部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
ZrSiO4+4NaOH═Na2ZrO3+Na2SiO3+2H2O
(2)为了提高浸出率可采取的方法有原料粉碎增大接触面积、加热或搅拌或多次浸取(列举两种)
(3)生成滤渣2的成分H2SiO3或H4SiO4(用化学式表示)
(4)用氨水将滤液2的pH调至2.4≤pH<3.4,目的是使Zr4+完全转化为Zr(OH)4沉淀,同时保证Al3+不会被沉淀下来.
(5)往流程中滤渣1中加入盐酸溶液,过滤不溶物后,再将滤液在不断通入HCl气流中气流同时蒸发浓缩、冷却结晶、过滤,可回收得到铁的氯化物FeCl3晶体.
4.能正确表示下列反应离子方程式的是( )
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | NaHCO3溶液中加入HCl:CO32-+2H+═CO2↑+H2O | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | “84消毒液”和“洁厕灵”(主要成分为盐酸)混合使用会产生有毒气体:$ClO_3^-$+5Cl-+6H+═3Cl2↑+3H2O |
 溶液中的化学反应大多是离子反应.根据要求回答下列问题.
溶液中的化学反应大多是离子反应.根据要求回答下列问题.