题目内容
6.在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,写出该反应的热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.0kJ/mol.现有CH4和CO的混合气体0.75mol,完全燃烧后,生成CO2气体和18g液态水,共放出QkJ热量(假定热量未损失),则CH4和CO的物质的量的比为2:1.分析 依据热化学方程式书写方法解答,标注物质聚集状态和反应焓变;根据H元素守恒计算CH4的物质的量,进而计算CO的物质的量.
解答 解:在298K,100kPa时.CH4的燃烧热是890.0kJ/mol,在298K时,1mol CH4在氧气中完全燃烧生成二氧化碳和液态水,放出热量890.0kJ,则该反应的热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.0kJ/mol,
18克液态水的物质的量=$\frac{18g}{18g/mol}$=1mol,根据H原子守恒可知n(CH4)=$\frac{1mol×2}{4}$=0.5mol,故n(CO)=0.75mol-0.5mol=0.25mol,
则CH4和CO的物质的量的比为2:1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O△H=-890.0kJ/mol;2:1.
点评 本题考查热化学方程式书写、热化学方程式计算,热化学方程式定量计算、元素守恒等计算是解答本题的关键,难度中等.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
16.下列有关蛋白质的叙述不正确的是( )
①向蛋白质溶液里加浓(NH4)2SO4溶液可提纯蛋白质
②蛋白质的分子能透过半透膜
③蛋白质水解的最终产物是氨基酸
④温度越高,酶对某些化学反应的催化效率越高
⑤任何结构的蛋白质遇到浓HNO3都会变黄色.
①向蛋白质溶液里加浓(NH4)2SO4溶液可提纯蛋白质
②蛋白质的分子能透过半透膜
③蛋白质水解的最终产物是氨基酸
④温度越高,酶对某些化学反应的催化效率越高
⑤任何结构的蛋白质遇到浓HNO3都会变黄色.
| A. | ①②③ | B. | ②③⑤ | C. | ③④⑤ | D. | ②④⑤ |
14.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | 金刚石和SiO2 | B. | CO2和SiO2 | C. | NaCl和 HCl | D. | 钠和KCl |
1.下列操作正确的是( )
| A. | 用pH试纸测定溶液的酸碱性时,应先用蒸馏水将其润湿 | |
| B. | 利用焰色反应鉴定样品中是否含有K+时,应透过蓝色钴玻璃观察火焰的颜色 | |
| C. | 在中和滴定过程中,视线应始终注视滴定管内的液面变化 | |
| D. | 将溴水中的溴单质提取出来,应使用酒精作萃取剂 |
18.A、B属于短周期元素,A的阳离子与B的阴离子具有相同的电子层结构.以下关于A、B的比较中,不正确的是( )
| A. | 原子半径:A<B | B. | 原子序数:A>B | ||
| C. | 原子最外层电子数:B>A | D. | 元素所在的周期数:A>B |
2.据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C-C≡C-C≡C-C≡C-C≡N.对该物质判断正确的是( )
| A. | 该物质与乙炔互为同系物 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 不能发生加聚反应 | |
| D. | 可由乙炔和含氮化合物通过取代反应制得 |
 已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答:
已知前四周期六种元素A、B、C、D、E、F的核电荷数依次增大.B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成AC型离子化合物,其中的阴、阳离子相差一个电子层.E4+离子和氩原子的核外电子排布相同,F元素含量决定了人体内血红蛋白携氧能力的大小.请回答: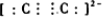 ,其中α键和π键数目之比为1:2.
,其中α键和π键数目之比为1:2.