题目内容
17.BF3的空间构型是平面三角形,而NF3的空间构型是三角锥形,H2S中心原子的杂化方式为sp3,CH4中心原子的杂化方式为sp3,这四个分子的键角大小关系是BF3>CH4>NF3>H2S.分析 根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,据此判断杂化类型和分子的空间构型.
解答 解:BF3中B原子的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,没有孤电子对,所以分子的空间构型是平面三角形;
NF3中N原子的价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,有一个孤电子对,所以分子的空间构型是三角锥形;
H2S中S原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,中心原子的杂化方式为sp3;
CH4中C原子的价层电子对数=4+$\frac{1}{2}$(4-4×1)=4,中心原子的杂化方式为sp3;这四个分子的键角大小关系是BF3>CH4>NF3>H2S.
故答案为:平面三角形;三角锥形;sp3;sp3;BF3>CH4>NF3>H2S.
点评 本题考查了原子杂化类型的判断,难度不大,根据“杂化轨道数=δ键数+孤对电子对数”来解答即可,原子杂化类型的判断是高考的热点,所以是学习的重点.

练习册系列答案
相关题目
8.下列有关说法中正确的是( )
| A. | 168O、178O、188O属于同位素 | |
| B. | N60和N2互为同系物 | |
| C. | O2和O3、H2和D2、H218O和H216O都互为同素异形体 | |
| D. | CH2O2、C2H4O2、C3H6O2、C4H8O2互为同系物;乙二醇、丙三醇也互为同系物 |
5.2016年3•15晚会曝光:“北口义齿”用废钢料制造假牙,经过反复回收再利用的这种“碎钢”,有害元素浓度越来越高,危害人体!而纯钛、钴铬、诺必灵等都是正规的义齿金属原料.钛合金烤瓷牙是目前国内使用最为普遍的一种烤瓷牙.
(1)TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取.
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ/mol,你认为这一氯化反应是否可自发进行?理论根据是什么?反应不能自发进行,因为此反应中△H>0,△S<0,△G=△H-T•△S>0,故此反应不能自发进行.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如图1:
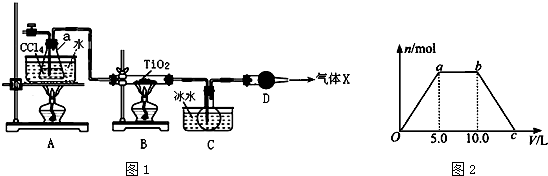
表是有关物质的性质:
请回答下列问题:
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气.
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,则混合稀溶液中Ba( OH)2和NaOH的物质的量之比为1:1; 从a点到b点依次发生的第一个反应的离子方程式是CO2+2OH-=CO32-+H2O.
(1)TiCl4是生产金属钛和钛白的原料,工业上主要用TiO2氯化的方法来制取.
①有人拟用以下氯化反应来制取TiCl4:TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)△H=+151kJ/mol,你认为这一氯化反应是否可自发进行?理论根据是什么?反应不能自发进行,因为此反应中△H>0,△S<0,△G=△H-T•△S>0,故此反应不能自发进行.
②工业上通常往TiO2和Cl2反应体系中加入碳单质,在一定条件下制取TiCl4,从化学平衡的角度解释此方法能顺利制取TiCl4的原因加入的碳单质与氧气反应,减小了产物O2的浓度,使TiO2(s)+2Cl2(g)?TiCl4(l)+O2(g)平衡向正反应方向移动,使反应能够顺利进行.
(2)某化学实验小组以TiO2和足量 CCl4为原料制取TiCl4,装置图如图1:

表是有关物质的性质:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
①实验开始时先点燃A处的酒精灯,待C中烧瓶里有液滴出现时再点燃B处的酒精灯,其主要目的是先排尽系统(装置)中的空气.
②本实验中仪器a采用题给的加热方式的突出优点是受热均匀,能为反应提供稳定的CCl4蒸汽流.
③B中TiO2发生反应的化学方程式是TiO2+CCl4$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4+CO2↑.
④欲分离C装置中的TiCl4,应采用的实验操作为蒸馏(填操作名称).
⑤若将反应过程中生成的气体X(足量)缓缓通入Ba( OH)2和NaOH的混合稀溶液中,生成沉淀的物质的量(n)和 通入气体X的体积(V)的关系如图2所示,则混合稀溶液中Ba( OH)2和NaOH的物质的量之比为1:1; 从a点到b点依次发生的第一个反应的离子方程式是CO2+2OH-=CO32-+H2O.
12.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:

已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成CoCl2.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,依次是蒸发(浓缩),冷却(结晶)和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则电池放电时的正极反应式为:CoO2+Li++e-=LiCoO2.


已知:①浸出液含有阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出加适量NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含3个基本实验操作,依次是蒸发(浓缩),冷却(结晶)和过滤.
(5)萃取剂对金属离子的萃取率与pH的关系如图1.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B(填选项序号).
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水(答一条即可).
(7)已知某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌
入电池负极材料碳-6(C6)中(如图2所示).若该电池的总反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,则电池放电时的正极反应式为:CoO2+Li++e-=LiCoO2.

9. B正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
B正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
已知:(1)2CH3CH2CH2CH2OH$→_{140℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
(2)反应物和产物的相关数据如下
制备过程如下:
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无
水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(3)步骤④中最后一次水洗的目的是洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(4)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃. 117℃. 135℃.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
 B正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:
B正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:已知:(1)2CH3CH2CH2CH2OH$→_{140℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O
(2)反应物和产物的相关数据如下
| 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.819 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
①将6mL浓硫酸和37g正丁醇,按一定顺序添加到A中,并加几粒沸石.
②加热A中反应液,迅速升温至135℃,维持反应一段时间.
③待A中液体冷却后将其缓慢倒入盛有70mL水的分液漏斗中,振摇后静置,分液得粗产物.
④粗产物依次用40mL水、20mL NaOH溶液和40mL水洗涤,分液后加入约3g无
水氯化钙颗粒,静置一段时间后弃去氯化钙.
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚.
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为先加入正丁醇,再加入浓硫酸.
(2)步骤③的目的是初步洗去浓H2SO4,振摇后静置,粗产物应从分液漏斗的上(填“上”或“下”)口分离出.
(3)步骤④中最后一次水洗的目的是洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4.
(4)步骤⑤中,加热蒸馏时应收集d(填选项字母)左右的馏分.
a.100℃. 117℃. 135℃.142℃
(5)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A.分水器中上层液体的主要成分为正丁醇,下层液体的主要成分为水.
7.下列做法中,不会对环境造成污染的是( )
| A. | 冬季居民的家中用煤取暖 | B. | 城市和乡村大力开展植树造林 | ||
| C. | 工厂排放烟尘的烟囱加高 | D. | 将城市的固体废弃物运向农村倾倒 |
