题目内容
 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.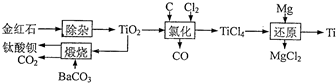
(1)Ti基态的电子排布式为
(2)TiCl4熔点为-24℃,沸点为136.4℃,室温下为无色液体,可溶于甲苯和氯代烃.固态TiCl4属于
(3)BaCO3为离子化合物.CO32-中C原子的杂化类型为
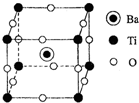
(4)钛酸钡的晶胞如图所示,其化学式为
(5)用锌还原TiCl4的盐酸溶液,经后续处理可制得绿色的配合物[TiCl(H2O)5]Cl2?H2O.1mol该配合物中含有σ键的数目为
考点:晶胞的计算,共价键的形成及共价键的主要类型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)根据Ti原子序数,根据能量最低原则、泡利不相容原理和洪特规则写出核外电子排布式;
(2)根据物理性质判断晶体类型;
(3)计算价电子对数,判断杂化类型;等电子体是指具有相同原子数和相同价电子数的原子团;
(4)利用均摊法计算化学式;
(5)根据配合物结构判断σ键的数目.
(2)根据物理性质判断晶体类型;
(3)计算价电子对数,判断杂化类型;等电子体是指具有相同原子数和相同价电子数的原子团;
(4)利用均摊法计算化学式;
(5)根据配合物结构判断σ键的数目.
解答:
解:(1)Ti原子序数为22,其核外电子排布式为:1s22s22p63s23p63d44s2,故答案为:1s22s22p63s23p63d44s2;
(2)TiCl4熔、沸点较低,可判断知其固态形式为分子晶体,故答案为:分子;
(3)CO32-中C原子价电子数为:
=3,即形成了三条杂化轨道,杂化类型为:sp2;CO32-,原子数为4,价电子数为:24,则NO3-、SiO32-,为其等电子体,
故答案为:sp2;NO3-、SiO32-;
(4)Ba位于体心,数目为1,Ti位于顶点,数目为8×
=1,O位于棱心,12×
=3,化学式为:BaTiO3,故答案为:BaTiO3;
(5)1molTi与1molCl和5molH2O,形成6molσ键,5molH2O内含有5×2=10molσ键,外界1molH2O内含有2molσ键,共含有6+10+2=18mol,故答案为:18mol.
(2)TiCl4熔、沸点较低,可判断知其固态形式为分子晶体,故答案为:分子;
(3)CO32-中C原子价电子数为:
| 4+2 |
| 2 |
故答案为:sp2;NO3-、SiO32-;
(4)Ba位于体心,数目为1,Ti位于顶点,数目为8×
| 1 |
| 8 |
| 1 |
| 4 |
(5)1molTi与1molCl和5molH2O,形成6molσ键,5molH2O内含有5×2=10molσ键,外界1molH2O内含有2molσ键,共含有6+10+2=18mol,故答案为:18mol.
点评:本题考查较为全面,涉及到电子排布式、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.

练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
下列物质:①BeCl2②SiC③白磷④BF3⑤NH3⑥过氧化氢其中含极性键的非极性分子是( )
| A、①③④ | B、②③⑥ |
| C、①④ | D、①③④⑤ |
下列有关实验装置进行的相应实验,不能达到实验目的是( )

| A、用装置①除去Cl2中含有的少量HCl |
| B、用装置②从KCl溶液中获得KCl晶体 |
| C、用装置③除去O2中混有的一定量SO2 |
| D、用装置④在实验室制取并收集氨气 |