题目内容
12.关于35℃的0.1mol/L NaOH溶液,以下表述错误的是( )| A. | Kw>1×10-14 | B. | 水电离的c(H+)>1×10-13 mol/L | ||
| C. | pH>13 | D. | c(OH-)=c(H+)+c(Na+) |
分析 水的电离是吸热过程,升高温度,水的离子积增大,据此判断即可.
解答 解:A.35℃时,水的离子积大于25℃时的水的离子积,故A正确;
B.常温下,0.mol/L的氢氧化钠溶液,水电离出的氢离子浓度为1×10-13 mol/L,升高温度,水的电离程度增大,故B正确;
C.此时0.1mol/L的氢氧化钠溶液pH小于13,故C错误;
D.由溶液呈电中性得出:c(OH-)=c(H+)+c(Na+),故D正确,故选C.
点评 本题主要考查的是水的电离,水是极弱的电解质,能微弱电离H2O?H++OH-;△H>0 25℃时,纯水中c(H+)=c(OH-)=1×10-7mol/L,难度不大.

练习册系列答案
相关题目
2.钴(${\;}_{27}^{60}Co$)是一种穿透力很强的核辐射元素,可用来治疗癌症.下列关于${\;}_{27}^{60}Co$的说法不正确的是( )
| A. | 钴的一种核素 | B. | 质子数为27 | C. | 核外电子数为27 | D. | 中子数为60 |
3.在标准状况下进行甲、乙、丙三组实验,三组实验均各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据如表:
(1)乙组实验中,盐酸过量(填“过量”、“适量”、“不足量”).
(2)要计算出盐酸的物质的量浓度,题中可作为计算依据的数据是乙或丙,求得盐酸的物质的量浓度为1mol/L.
(3)求合金中镁、铝的物质的量之比,题中可作为计算依据的数据是甲,求得的镁、铝的物质的量之比是1:1.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(2)要计算出盐酸的物质的量浓度,题中可作为计算依据的数据是乙或丙,求得盐酸的物质的量浓度为1mol/L.
(3)求合金中镁、铝的物质的量之比,题中可作为计算依据的数据是甲,求得的镁、铝的物质的量之比是1:1.
7.R分子的质量为a g,相对质量为M,则M与a的比值等于( )
| A. | 6.02×1023 | B. | 12C原子质量的十二分之一 | ||
| C. | 0.012Kg12C所含的原子数 | D. | 1mol氧气所含的微粒数 |
17.NH3与Cl2反应的产物不可能是( )
| A. | N2、HCl | B. | NH4Cl、H2 | C. | N2、NH4Cl | D. | N2、HCl、NH4Cl |
4.青蒿素结构如图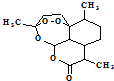 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).
a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应: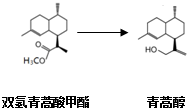
常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
某学习小组在实验室用双氢青蒿酸甲酯制取青蒿醇.
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).a.化学式为C15H21O5 b.不能与NaOH溶液反应
c.易溶于水 d.含有过氧键,有较强氧化性
由青蒿酸为原料出发,经五步合成可得到青蒿素.其中第2步为还原反应:

常温下即可反应且略放热,还原剂为LiAlH4.相关物质的性质:
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |
(1)反应中使用过量的氢化铝锂,理由是提高双氢青蒿酸甲酯的转化率.
为使反应在溶液状态下进行,可用乙醚为溶剂,不用水的理由是双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应.
(2)请设计实验室制备装置(画出草图):

(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂.从反应混合物中提取青蒿醇的方法是:
①加盐酸后分液;
②从乙醚层提取青蒿醇.有多种方法,以下是二种方案:
方案一:蒸发结晶. 方案二:蒸馏析出晶体.
a.这2个方案在析出晶体后都应有残留液,原因是防止氢青蒿酸甲酯析出.
b.请对这2个方案进行比较方案二可回收乙醚、甲醇.
1.如图是模拟电化学反应装置图.下列说法正确的是( )
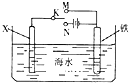

| A. | 若X为碳棒,开关K置于N处,可以加快铁的腐蚀 | |
| B. | 若X为碳棒,开关K置于N处,则X极附近溶液变黄色 | |
| C. | 若X为锌,开关K置于M处,保护铁电极则为牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于M处,则X电极的反应式为:O2+4e+2H2O→4OH- |
2.一定量的MnO2与xmL10mol/L的盐酸共热制取氯气,在标准状况下产生2.24L.则x的值应为( )
| A. | x=20 | B. | x=40 | C. | 20<x<40 | D. | x>40 |
 .
.