题目内容
1.25℃时,浓度为0.1mol•L-1的6种溶液,①HCl ②CH3COOH ③Ba(OH)2 ④Na2CO3 ⑤KCl ⑥NH4Cl溶液pH由小到大的顺序为①②⑥⑤④③(填写编号).分析 先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH.
解答 解:盐酸和醋酸为酸,氢氧化钡为碱,碳酸钠、氯化钾和氯化铵为盐,碳酸钠为强碱弱酸盐,其溶液呈碱性,氯化钾为强酸强碱盐,为中性,氯化铵为强酸弱碱盐,其溶液为酸性,相同浓度的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,所以pH盐酸小于醋酸,则这几种溶液的pH由小到大的顺序是①②⑥⑤④③.
故答案为:①②⑥⑤④③.
点评 本题依托弱电解质的电离和盐的水解,考查了pH大小的判断知识点,明确物质的性质及弱电解质电离特点是解本题关键.

练习册系列答案
相关题目
9.下列物质:①丙氨酸 ②醋酸 ③蛋白质 ④小苏打 ⑤Al(OH)3⑥苯酚钠 ⑦(NH4)2SO3.其中既能与盐酸反应又能与NaOH反应的是( )
| A. | ①④⑤⑥ | B. | 全部 | C. | ①③④⑤⑥ | D. | ①③④⑤⑦ |
16.下列叙述中错误的是(用NA代表阿伏加德罗常数的值)( )
①46gNO2和N2O4的混合气体中含N原子总数为NA
②用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA
③7.8gNa2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023
④标准状况下,22.4LH2O含有的分子数为NA
⑤等物质的量的NH4+和OH-含电子数均为10NA .
①46gNO2和N2O4的混合气体中含N原子总数为NA
②用含0.1molFeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA
③7.8gNa2S和Na2O2的混合物中含有阴离子数大于0.1×6.02×1023
④标准状况下,22.4LH2O含有的分子数为NA
⑤等物质的量的NH4+和OH-含电子数均为10NA .
| A. | ①②③④⑤ | B. | ①③④⑤ | C. | ②③④⑤ | D. | ③④⑤ |
6.下列工业生产的主要化学反应不涉及应用勒夏特列原理进行控制的是 ( )
| A. | 合成氨 | B. | 制硫酸 | C. | 制盐酸 | D. | 制纯碱 |
13.现有四种溶液:①NH4Cl,②(NH4)2SO4,③NaCl,④Na2SO4,下列试剂能将它们区别开的是( )
| A. | HCl | B. | BaCl2 | C. | NaOH | D. | Ba(OH)2 |
 +2H2O 反应类型为:酯化反应.
+2H2O 反应类型为:酯化反应.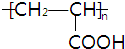 .
.