题目内容
12.NA表示阿伏加德罗常数的值.下列说法中正确的是( )①常温下,0.1molCl2与足量NaOH溶液反应,转移的电子数目为0.2NA
②常温常压下,18g H2O中含有的电子总数为10NA
③将100mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
④在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA
⑤电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜.
| A. | ①⑤ | B. | ③④ | C. | ②④ | D. | ②③ |
分析 ①常温下,0.1molCl2与NaOH溶液的反应为歧化反应;
②求出水的物质的量,然后根据水为10电子微粒来分析;
③一个(OH)3胶粒是多个氢氧化铁的聚集体;
④在反应KIO3+6HI═KI+3I2+3H2O中,转移5mol电子;
⑤电解精炼铜时,在阳极上放电的不止是铜.
解答 解:①常温下,氯气与NaOH溶液的反应为歧化反应,0.1molCl2转移0.1mol电子即0.1NA个,故错误;
②18g水的物质的量为1mol,而水为10电子微粒,故1mol水中含10mol电子即10NA个,故正确;
③一个(OH)3胶粒是多个氢氧化铁的聚集体,故将100mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA,故错误;
④在反应KIO3+6HI═KI+3I2+3H2O中,转移5mol电子,生成3mol碘,故当100mL 0.1mol•L-1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA,故正确;
⑤电解精炼铜时,在阳极上放电的不止是铜,还有比铜活泼的杂质,故当电路中转移NA个电子时,阳极上溶解的铜的质量小于32g,故错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
2.在日常生活中,下列解决问题的方法不可行的是( )
| A. | 为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土 | |
| B. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中 |
3.下列金属冶炼的反应原理,错误的是( )
| A. | 2NaCl(熔融)$\frac{\underline{\;通电\;}}{\;}$ 2Na+Cl2↑ | B. | Al2O3+3H2 $\frac{\underline{\;\;△\;\;}}{\;}$2Al+3H2O | ||
| C. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$ 2 Fe+3CO2 | D. | MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑ |
20.下列说法不正确的是( )
| A. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 | |
| B. | 原子吸收光谱可用于测定物质中的金属元素,红外光谱可用于测定化合物的官能团 | |
| C. | 阴极射线、a粒子散射实验及布朗运动发现都对原子模型建立做出了贡献 | |
| D. | 常温常压下2g氦气含有的质子数与31g白磷中含有的P-P键数不一样多 |
7.以下事实中,能证明无色透明液体是纯水的是( )
| A. | 在1.01×105Pa时,测得该液体的沸点是100℃ | |
| B. | T℃时,测得该液体的c(OH-)=$\sqrt{Kw}$mol/L | |
| C. | 电解该液体时,得到H2和O2体积比为2﹕1(相同条件) | |
| D. | 该液体能与乙醇以任意比互溶,且能与钠剧烈反应放出气体 |
17.下列反应属于氧化还原反应的是( )
| A. | Mg3N2+6H2O═3Mg(OH)2+2NH3↑ | B. | Na2O2+2H2O═2NaOH+H2O2 | ||
| C. | FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl | D. | CaH2+2H2O═Ca(OH)2+2H2↑ |
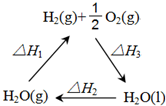 盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0.
盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的.某化学过程如图所示,△H1、△H2、△H3三者之间的关系式为△H1+△H2+△H3=0. 计算:
计算: