题目内容
7.下列各组微粒的空间构型相同的是( )①NH3和H2O
②NH4+和H3O+
③NH3和H3O+
④O3和SO2
⑤CO2和BeCl2.
| A. | 全部 | B. | ③④⑤ | C. | 除④以外 | D. | ②⑤ |
分析 根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断.
解答 解:①NH3中价层电子对个数=3+$\frac{1}{2}$×(5-3)=4且含有一个孤电子对,所以为三角锥形,H2O中价层电子对个数=2+$\frac{1}{2}$×(6-2)=4且含有两个孤电子对,所以为V形结构,二者空间构型不同,故①错误;
②NH4+中价层电子对个数是4且不含孤电子对,为正四面体形结构;H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,二者空间构型不同,故②错误;
③NH3为三角锥形结构、H3O+中O原子价层电子对个数=3+$\frac{1}{2}$(6-1-3×1)=4且含有一个孤电子对,所以为三角锥形结构,所以二者空间构型相同,故③正确;
④O3、SO2中价层电子对个数都是3且都含有一对孤电子对,所以分子空间构型都是V形,故④正确;
⑤CO2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$(4-2×2)=2,所以二氧化碳是直线型结构,BeCl2中Be价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$(2-2)=2,是sp杂化,是直线型结构,二者空间构型相同,故⑤正确;
故选B.
点评 本题考查了微粒空间构型的判断,根据价层电子对理论解答,注意孤电子对个数=$\frac{1}{2}$×(a-xb)中各个字母的含义,H3O+中O原子价层电子对个数,为易错点,题目难度中等.

| A. | 硫酸与氢氧化钡反应:SO42-+Ba2+═BaSO4↓ | |
| B. | 醋酸滴在锌片上:Zn+2H+=Zn2++H2↑ | |
| C. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O | |
| D. | 氯化铝溶液中加过量氨水:Al3++3NH3•H2O=Al (OH)3↓+3NH4+ |
①乙烷、②CHCl3、③甲烷、④四氯化碳、⑤白磷(P4)
| A. | ①②③ | B. | ③④⑤ | C. | ①④⑤ | D. | ②③④ |
| A. | BaCl2 | B. | H2SO4 | C. | AgNO3 | D. | NaOH |
| 选项 | 实验事实 | 结论 |
| A | H2可在Cl2中燃烧 | 燃烧不一定有氧气参加 |
| B | 铝箔在酒精灯火焰上加热熔化但不滴落 | 氧化铝熔点高于铝 |
| C | 将SO2通入含HClO的溶液中,生成H2SO4 | HClO酸性比H2SO4强 |
| D | 向FeCl2溶液中滴入KSCN溶液,在液面出现血红色 | Fe2+在空气中被氧化 |
| A. | A | B. | B | C. | C | D. | D |

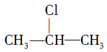 +NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,
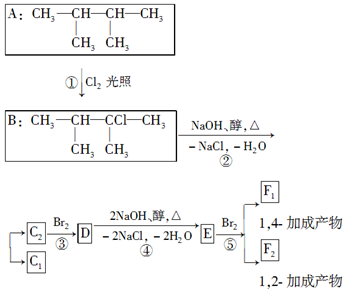
+NaOH$→_{△}^{醇}$CH3-CH═CH2+NaCl+H2O,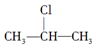 $→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系:
$→_{-NaCl,-H_{2}O}^{NaOH、醇、△}$CH3-CH═CH2下面是几种有机化合物的转化关系: