题目内容
13.下列物质的工业生产原理不涉及氧化还原反应的是( )| A. | 烧碱 | B. | 纯碱 | C. | 硫酸 | D. | 液溴 |
分析 有电子转移的化学反应是氧化还原反应,其特征是有元素化合价的变化.
解答 解:A.工业生产烧碱涉及的反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,该反应中有电子的转移,属于氧化还原反应,故A不选;
B.氨碱法生产纯碱涉及的方程式为:NH3+CO2+H2O+NaCl═NaHCO3+NH4Cl、2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,这几个方程式中都没有电子的转移,所以不涉及氧化还原反应,故B选;
C.硫酸工业中存在S~SO2~SO3的转化,化合价发生变化,为氧化还原反应,故C不选;
D.工业生产液溴利用氯气将溴离子氧化成溴单质,化合价发生变化,为氧化还原反应,故D不选;
故选B.
点评 本题考查氧化还原反应、化学工业原理,明确各工业生成原理是解本题关键,难度不大.

练习册系列答案
相关题目
1.NA表示阿伏伽德罗常数,下列有关说法正确的是( )
| A. | 32gO2和O3的混合物中,所含氧原子数为2NA | |
| B. | 标准状况下,22.4LCl2与水反应,转移电子数为2NA | |
| C. | 标准状况下,3.36L辛烷中,所含碳原子数为1.5NA | |
| D. | 含1molFeCl3的饱和溶液,逐滴加入沸水中,完全形成Fe(OH)3胶体,胶粒数为NA |
8.化学与生产、生活密切相关.下列说法错误的是( )
| A. | 用CO2合成可降解塑料聚碳酸酯,实现“碳”的循环利用 | |
| B. | 由地沟油加工合成的“生物柴油”与柴油成分相同 | |
| C. | 高温消毒就是用加热的方法使蛋白质变性 | |
| D. | 海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
18.25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )
| A. | 纯硫酸的摩尔质量为98 | |
| B. | 上述100mL稀硫酸中含溶质14g | |
| C. | 上述稀释过程所需要的蒸馏水为90mL | |
| D. | 质量分数为50%的硫酸物质的量浓度为7.14mol/L |
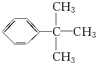
5.某有机物的结构如图所示,下列说法错误的是( )
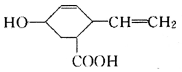

| A. | 分子式为C9H12O3,可以燃烧 | |
| B. | 能发生取代反应和聚合反应 | |
| C. | 能使酸性高锰酸钾溶液和溴的CCl4溶液褪色,褪色原理相同 | |
| D. | 分子中所有碳原子不可能共平面 |
2.大苏打是五水合硫代硫酸钠(Na2S2O3•5H2O)的俗称,又称海波,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成.向Na2CO3和Na2S混合溶液中通入SO2反应后制得Na2S2O3•5H2O,通常制得的产品含有少量Na2SO3和Na2SO4.
Ⅰ、某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O),实验装置如图所示(省略夹持装置):
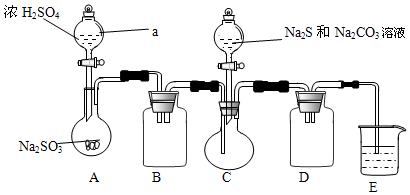
实验步骤:
(1)检查装置气密性,按图示加入试剂.仪器a的名称是分液漏斗,组装仪器之前必须检查仪器a是否漏水的操作是关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水.E中NaOH溶液的作用是吸收SO2,防止污染空气.
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.A装置中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)待C反应结束后,过滤其混合物,将滤液蒸发浓缩、结晶、过滤、洗涤、干燥,得到产品.
Ⅱ.【探究与反思】
(4)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)
(5)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是先向A中烧瓶滴加浓H2SO4,产生的气体将装置中空气排尽后,再向C中烧瓶加入Na2S和Na2CO3混合溶液.
(6)为测定所得样品中Na2S2O3•5H2O的纯度,称取mg产品配成稀溶液并除去Na2SO3和Na2SO4,然后用c mol•L-1标准碘溶液进行滴定(用淀粉溶液作指示剂),反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.若三次滴定平均消耗碘溶液的体积为V mL,则测量的Na2S2O3•5H2O的纯度为$\frac{49.6cV}{m}$%.(已知Na2S2O3•5H2O的式量是248)
Ⅰ、某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O),实验装置如图所示(省略夹持装置):

实验步骤:
(1)检查装置气密性,按图示加入试剂.仪器a的名称是分液漏斗,组装仪器之前必须检查仪器a是否漏水的操作是关闭活塞,向分液漏斗内注入一定量水,观察活塞是否漏水,旋转活塞1800观察活塞是否漏水.E中NaOH溶液的作用是吸收SO2,防止污染空气.
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加H2SO4.A装置中发生反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(3)待C反应结束后,过滤其混合物,将滤液蒸发浓缩、结晶、过滤、洗涤、干燥,得到产品.
Ⅱ.【探究与反思】
(4)为验证产品 中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.(所需试剂从稀HNO3、稀H2SO4、稀HCl、BaCl2溶液、蒸馏水中选择)
| 实验操作 | 现象 | 结论 |
| 取适量产品配成稀溶液,滴加足量BaCl2溶液 | 有白色沉淀生成 | |
| 过滤,用蒸馏水洗涤沉淀,向沉淀中加入足量稀HCl | 沉淀部分溶解,并有刺激性气味的气体产生 | 确定产品中含有Na2SO3和Na2SO4 |
(6)为测定所得样品中Na2S2O3•5H2O的纯度,称取mg产品配成稀溶液并除去Na2SO3和Na2SO4,然后用c mol•L-1标准碘溶液进行滴定(用淀粉溶液作指示剂),反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.若三次滴定平均消耗碘溶液的体积为V mL,则测量的Na2S2O3•5H2O的纯度为$\frac{49.6cV}{m}$%.(已知Na2S2O3•5H2O的式量是248)
13.某化学兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验.
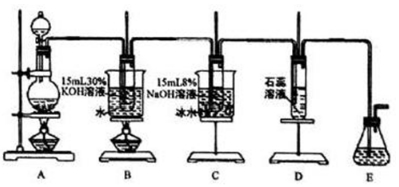
实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、漏斗、玻璃棒.为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是在A和B之间添加盛有饱和NaCl的洗气装置.
(3)装置 C 中反应需要在冰水浴中进行,其原因是温度升高会生成氯酸钠.
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为黄绿色.
实验Ⅱ尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设 3:只存在ClO.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液.

实验I.制取氮酸钾、次氯酸钠和氯水
(1)写出装置A实验室制取Cl2的化学反应方程式Mn2O+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、漏斗、玻璃棒.为提高氯酸钾和次氯酸钠的产率,在实验装置中还需要改进的是在A和B之间添加盛有饱和NaCl的洗气装置.
(3)装置 C 中反应需要在冰水浴中进行,其原因是温度升高会生成氯酸钠.
(4)装置D中的实验现象是溶液先变红后褪色,最后又变为黄绿色.
实验Ⅱ尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)
①提出合理假设
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设 3:只存在ClO.
②设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4、1mol/LNaOH 溶液、0.01mol/L 酸性 KMnO4 溶液、淀粉 KI 溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol•L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ------------- |
| 步骤2: 向A试管中加入1-2mL 0.0lmol•L-1 KMnO4溶液,振荡试管 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
| 步骤3: 向B试管中滴加1-2滴淀粉-KI溶液 | (1)若溶液变蓝,则假设成立 (2)若溶液不变蓝,综合步骤中的(2),则假设2成立 |
 .
. .
.
 ;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.
;该催化氧化反应的化学方程式为2CH3CH(OH)CH2CH3+O2 $→_{△}^{Cu}$ 2CH3COCH2CH3+2H2O.