题目内容
12.下列说法正确的是( )| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| C. | 二氧化锰具有氧化性,既能氧化浓盐酸制氯气,也能将双氧水氧化为氧气 | |
| D. | 氮的氧化物是形成光化学烟雾的主要物质 |
分析 A.溶解N、S的氧化物的雨水为酸雨;
B.常温下Al与浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生;
C.二氧化锰可催化双氧水的分解;
D.氮的氧化物有毒,为常见的空气污染物.
解答 解:A.正常雨水的pH约为5.6,而溶解N、S的氧化物的雨水为酸雨,酸雨的pH<5.6,故A错误;
B.常温下Al与浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则用铝制容器存放浓硝酸,故B错误;
C.二氧化锰可催化双氧水的分解,而二氧化锰具有氧化性,既能氧化浓盐酸制氯气,故C错误;
D.氮的氧化物有毒,为常见的空气污染物,是形成光化学烟雾的主要物质,故D正确;
故选D.
点评 本题考查三废处理及环境保护,为高频考点,把握环境污染物、环境污染问题、物质的性质及反应为解答的关键,侧重分析与应用能力的考查,注意化学与生活、环境的联系,题目难度不大.

练习册系列答案
相关题目
19. 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
Ⅲ.NO2和NO都能被KMnO4氧化吸收
Ⅳ.铁氰化钾化学式为K3[Fe(CN)6]:亚铁氰化钾化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓(蓝色沉淀)
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是B
A.常温下铁和浓硝酸不反应
B.铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生
C.反应需要催化剂
(2)甲的实验操作中通入CO2的主要目的是A
A.排除反应体系中的空气,防止干扰
B.将产生的气体压入后续装置吸收
C.维持系统内压强平衡
(3)甲取少量B中溶液,加热,现象是AD
A.棕色溶液变浅绿色 B.棕色溶液变无色 C.有红棕色气体逸出
D.有无色气体逸出 E.产生红褐色沉淀
(4)乙认为有NO生成的证据不足.乙仍采用该装置和操作进行对照实验,浓硝酸换成稀硝酸,证明有NO生成的实验现象是A中没有红棕色气体生成B中溶液变为棕色
(5)将A所得溶液稀释至500mL,取少量稀释后的溶液调节pH后,滴加铁氰化钾溶液有蓝色沉淀生成.另取稀释后的溶液25.00mL加入过量的KI固体,充分反应后pH至7左右,滴入几滴淀粉溶液做指示剂,用0.25mo1/L Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液16.00mL.(己知:I2+2S2O32-=2I-+S4O62-),则A中所得溶液的c(Fe3+)=0.16mo1/L.
 甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.
甲,乙两同学用图所示装置进行实验探究硝酸与铁反应的产物.文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物.
Ⅱ.FeSO4+NO?Fe(NO)SO4(棕色)△H<0.
Ⅲ.NO2和NO都能被KMnO4氧化吸收
Ⅳ.铁氰化钾化学式为K3[Fe(CN)6]:亚铁氰化钾化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-═Fe4[Fe(CN)6]3↓(蓝色沉淀)
甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅. ②反应停止后,A中无固体剩余,得100mL的溶液 |
(1)滴入浓硝酸加热前没有明显现象的原因是B
A.常温下铁和浓硝酸不反应
B.铁遇浓硝酸形成致密氧化膜,阻止反应进一步发生
C.反应需要催化剂
(2)甲的实验操作中通入CO2的主要目的是A
A.排除反应体系中的空气,防止干扰
B.将产生的气体压入后续装置吸收
C.维持系统内压强平衡
(3)甲取少量B中溶液,加热,现象是AD
A.棕色溶液变浅绿色 B.棕色溶液变无色 C.有红棕色气体逸出
D.有无色气体逸出 E.产生红褐色沉淀
(4)乙认为有NO生成的证据不足.乙仍采用该装置和操作进行对照实验,浓硝酸换成稀硝酸,证明有NO生成的实验现象是A中没有红棕色气体生成B中溶液变为棕色
(5)将A所得溶液稀释至500mL,取少量稀释后的溶液调节pH后,滴加铁氰化钾溶液有蓝色沉淀生成.另取稀释后的溶液25.00mL加入过量的KI固体,充分反应后pH至7左右,滴入几滴淀粉溶液做指示剂,用0.25mo1/L Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3溶液16.00mL.(己知:I2+2S2O32-=2I-+S4O62-),则A中所得溶液的c(Fe3+)=0.16mo1/L.
20.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol Fe在0.1 mol Cl2中充分燃烧,转移的电子数为0.3NA | |
| B. | 1 mol CnH2n+2分子中含共价键数目为(3n+1)NA | |
| C. | 含NA个氧原子的O2与含NA个氧原子的O3的质量比为2:3 | |
| D. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
17.下列化学用语表示正确的是( )
| A. | Mg2+的结构示意图: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | H2O2的电子式: | |
| D. | 小苏打的电离方程式:NaHCO3?Na++HCO3- |
4.下列反应的离子方程式书写错误的是( )
| A. | 氢氧化钠溶液与盐酸发生中和反应 OH-+H+═H2O | |
| B. | 氢氧化钡溶液与硫酸溶液发生中和反应 2OH-+2H+═2H2O | |
| C. | 稀盐酸滴在大理石上 CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向氯化钠溶液中滴加硝酸银溶液 Cl-+Ag+═AgCl↓ |
1.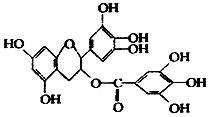 美国梅奥诊所的研究人员发现,绿茶中含有 EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知 EGCG 的结构式如图,有关 EGCG 的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有 EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知 EGCG 的结构式如图,有关 EGCG 的说法错误的是( )
 美国梅奥诊所的研究人员发现,绿茶中含有 EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知 EGCG 的结构式如图,有关 EGCG 的说法错误的是( )
美国梅奥诊所的研究人员发现,绿茶中含有 EGCG(表示没食子儿茶素没食子酸酯)物质具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,已知 EGCG 的结构式如图,有关 EGCG 的说法错误的是( )| A. | EGCG 的分子式为 C22H18O11 | |
| B. | EGCG 在空气中易氧化,其分子中含有 3 个手性碳原子 | |
| C. | 1molEGCG 最多可与含 9mol 氢氧化钠的溶液完全作用 | |
| D. | EGCG 能与碳酸钠溶液反应,还能和甲醛反应 |
2.在研究有机物的组成和结构时,可用于确定化学键和官能团信息的方法是( )
| A. | 质谱法 | B. | 红外光谱法 | C. | 核磁共振氢谱法 | D. | 燃烧法 |