题目内容
7.叠氮化物是一类重要化合物,在炸药、磁性化合物研究、微量元素测定方面越来越引起人们的重视,其中氢叠氮酸(HN3)是一种弱酸(如图甲为分子结构示意图),它的酸性类似于醋酸,可微弱电离出H+和N3-.请回答: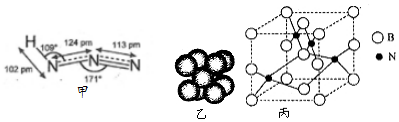
(1)联氮(N2H4)被亚硝酸氧化时便可生成氢叠氮酸HN3,该化学反应方程式可表示为N2H4+HNO2═2H2O+HN3.
(2)叠氮化物能与Fe3+、Cu2+及CO3+等形成配合物,如:[Co(N3)(NH3)5]SO4,在该配合物中钴显+3价,根据价层电子互斥理论可知SO42-的空间形状为正四面体,则钴原子在基态时的核外电子排布式为1s22s22p63s23p63d74s2.
(3)下列说法正确的是AD(选填序号):
A.HN3是极性分子 B.HN3中三个氮原子采用的都是sp3杂化
C.HN3中有4个σ键 D.N2H4沸点高达113.5℃,表明该分子间形成了氢键
(4)由叠氮化钠(NaN3)热分解可得光谱纯N2:2NaN3(S)═2Na(l)+3N2(g),下列说法正确的是AC (填序号).
A.氮的第一电离能大于氧
B.NaN3与KN3结构类似,前者晶格能较小
C.钠晶胞结构如图乙,晶胞中分摊2个钠原子
D.因N的电负性小,故N2常温下很稳定
(5)与N3-互为等电子体的分子有N2O、CO2(写两个化学式).
(6)人造立方氮化硼的硬度仅次于金刚石而远远高于其他材料,因此它与金刚石统称为超硬材料.立方氮化硼晶胞如图丙所示.
①该晶体的类型为原子晶体; ②晶体中每个N同时吸引4个B原子;③设该晶体的摩尔质量为M g•mol-1,晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则晶体中两个距离最近的N原子之间的距离为$\root{3}{\frac{M}{2×1{0}^{-30}d{N}_{A}}}$ pm.
分析 (1)联氮(N2H4)被亚硝酸氧化生成氢叠氮酸HN3,发生归中反应,另一个产物为水,结合原子守恒即可配平得反应方程式;
(2)该配合物中叠氮酸根离子为-1价、硫酸根离子为-2价,据此判断钴离子化合价;硫酸根离子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子空间构型;Co是27号元素,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式;
(3)A.分子正负电荷重心不重合的为极性分子;
B.HN3中三个N原子价层电子对个数不相同;
C.共价单键为σ键,共价双键中1个是σ键、1个是π键;
D.形成氢键的氢化物熔沸点较高;
(4)B.NaN3与KN3结构类似,且二者都是离子晶体,晶格能与离子半径成反比;
C.晶胞中Na原子个数=8×$\frac{1}{8}$+1;
A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素;
D.氮气分子中含有氮氮三键,键能较大;
(5)原子个数相等价电子数相等的微粒互为等电子体;
(6)①原子晶体硬度大;
②每个N原子同时吸引4个B原子;
③晶体中两个距离最近的B之间的距离为晶胞棱长的$\frac{1}{2}$倍,晶胞棱长=$\root{3}{\frac{m}{d}}$.
解答 解:(1)联氨被亚硝酸氧化时便可生成氢叠氮酸(HN3),发生反应的化学方程式为N2H4+HNO2═2H2O+HN3,故答案为:N2H4+HNO2═2H2O+HN3;
(2)该配合物中叠氮酸根离子为-1价、硫酸根离子为-2价,根据化合物中各元素化合价的代数和为0知,Co元素化合价为+3价;硫酸根离子价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断硫酸根离子空间构型为正四面体形;Co是27号元素,其原子核外有27个电子,根据构造原理书写其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2,
故答案为:+3;正四面体;1s22s22p63s23p63d74s2或[Ar]3d74s2;
(3)A.分子正负电荷重心不重合的为极性分子,HN3分子正负电荷重心都不重合,为极性分子,故A正确;
B.HN3中三个N原子价层电子对个数不相同,所以其杂化方式不同,故B错误;
C.共价单键为σ键,共价双键中1个是σ键、1个是π键,所以该分子中含有3个σ键,故C错误;
D.形成氢键的氢化物熔沸点较高,该氢化物熔沸点大于水,含有氢键,故D正确;
故选AD;
(4)A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能N>O,故A正确;
B.NaN3与KN3结构类似,且二者都是离子晶体,晶格能与离子半径成反比,钾离子半径大于钠离子,所以前者晶格能大于后者,故B错误;
C.晶胞中Na原子个数=8×$\frac{1}{8}$+1=2,故C正确;
D.氮气分子中含有氮氮三键,键能较大,性质较稳定,故D错误;
故选AC;
(5)原子个数相等价电子数相等的微粒互为等电子体,与N3-互为等电子体的分子有N2O、CO2、CS2、BeF2等,故答案为:N2O、CO2、CS2、BeF2等;
(6)①原子晶体硬度大,该晶体硬度大,所以为原子晶体,故答案为:原子;
②每个N原子同时吸引4个B原子,所以其配位数是4,故答案为:4;
③晶体中两个距离最近的B之间的距离为晶胞棱长的$\frac{1}{2}$倍,晶胞棱长=$\root{3}{\frac{m}{d}}$,则晶体中两个距离最近的B之间的距离=$\frac{1}{2}$×$\root{3}{\frac{m}{d}}$cm=$\frac{1}{2}$×$\root{3}{\frac{4M}{d{N}_{A}}}$cm=$\root{3}{\frac{M}{2d{N}_{A}}}$cm=$\root{3}{\frac{M}{2×1{0}^{-30}d{N}_{A}}}$pm,
故答案为:$\root{3}{\frac{M}{2×1{0}^{-30}d{N}_{A}}}$.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生知识运用、计算及空间想象能力,涉及晶胞计算、元素周期律、基本概念等知识点,难点是晶胞计算,题目难度中等.

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H在T℃时,向2.0L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见表:
| t/min | 0 | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
| A. | 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol•L-1•min-1 | |
| B. | 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol•L-1,则反应的△H>0 | |
| C. | 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行 | |
| D. | 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20% |
| A. | 1L 0.1 mol•L-1的氨水中有0.1NA个NH4+ | |
| B. | 标准况下,22.4L盐酸含有NA个HCl分子 | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为0.5 NA | |
| D. | 标准状况下,6.72 LN02与水充分反应转移的电子数目为0.2 NA |
| A. | M3O4、MO 1:1 | B. | MO2、MO 3:1 | C. | M3O4、MO2 2:1 | D. | MO2、MO 1:4 |
 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确的是( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确的是( )| A. | V(NaOH)=0 mL时,两份溶液中,c(X-)>c(Y-) | |
| B. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) | |
| C. | V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Na+)=c(Y-) |
| A. | pH在5.6~7.0之间的降水通常称为酸雨 | |
| B. | 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸 | |
| C. | 二氧化锰具有氧化性,既能氧化浓盐酸制氯气,也能将双氧水氧化为氧气 | |
| D. | 氮的氧化物是形成光化学烟雾的主要物质 |
| A. | 1 | B. | 4 | C. | 3 | D. | 8 |
| A. | 乙酸乙酯中的乙酸(NaOH溶液,蒸馏) | B. | 乙烷中的乙烯(酸性KMnO4溶液,洗气) | ||
| C. | 溴苯中的溴(KI溶液,分液) | D. | 乙醇中的水(生石灰,蒸馏) |
| A. | CO2的电子式是: | B. | 聚丙烯的结构简式: | ||
| C. | 次氯酸的结构式:H-Cl-O | D. | 丙烷分子的球棍模型为: |