题目内容
8.葡萄酒中常用Na2S2O5做抗氧化剂,0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5.溶液中部分微粒浓度随溶液酸碱性变化如图所示,对该溶液的下列说法中正确的是( )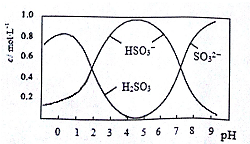
| A. | 向pH=4的溶液中滴加BaCl2溶液,会有白色沉淀产生 | |
| B. | pH=4.5时c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | pH=5时c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-) | |
| D. | 向pH=5.5的溶液中滴加溴水,反应的离子方程式为H2SO3+Br2+H2O=4H++SO42-+2Br- |
分析 A.pH=4的溶液中主要是HSO3-和少量H2SO3,加入BaCl2溶液无沉淀生成;
B.根据图可知,pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,溶液中存在电荷守恒和物料守恒分析判断;
C.pH=5时主要是HSO3-和少量SO32-溶液显酸性;
D.pH=5.5的溶液中主要是HSO3-和少量SO32-溶液显酸性,无H2SO3;
解答 解:A.pH=4的溶液中主要是HSO3-和少量H2SO3,溶液中亚硫酸根离子不能结婚钡离子生成沉淀,加入BaCl2溶液无沉淀生成,故A错误;
B.pH=4.5时,溶液中主要以亚硫酸氢根离子形式存在,溶液中存在电荷守恒和物料守恒,c(Na+)+c(H+)=2c(SO32-)+c(OH-)+c(HSO3-),c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),得到c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故B正确;
C.pH=5时主要是HSO3-和少量SO32-溶液显酸性,c(SO32-)<c(H+),故C错误;
D.pH=5.5的溶液中主要是HSO3-和少量SO32-溶液显酸性,无H2SO3 向pH=5.5的溶液中滴加溴水反应是HSO3-被溴单质氧化,故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小比较、电荷守恒和物料守恒、主要是图象变化分析和离子存在的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
18.核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法中不正确的是( )
| A. | 最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物易溶于水 | D. | 是活泼的非金属元素 |
19.含氮化合物是化学与工业中运用广泛的物质.
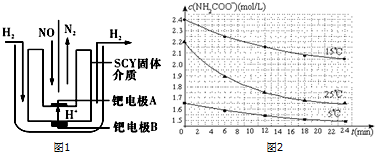
(1)该小组利用电解原理设计了如图1装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极).铂电极B是阳极,钯电极A的电极反应式为2NO+4H++4e-=N2+2H2O.
(2)若工业废水中的NO2-的浓度约为1.0×10-4 mol•L-1,取工业废水5mL 于试管中,滴加2滴0.1mol•L-1的硝酸银溶液,能否看到沉淀现象?试通过计算说明.(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol.请计算热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=-229KJ/mol
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
?根据表中数据,列式计算25.0℃时的分解平衡常数:K=c(CO2)•c2(NH3)=[4.8×10-3×$\frac{2}{3}$]2×[4.8×10-3×$\frac{1}{3}$]=1.64×10-8.
?已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.根据图中信息,如何说明水解反应速率随温度升
高而增大:25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.

(1)该小组利用电解原理设计了如图1装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极).铂电极B是阳极,钯电极A的电极反应式为2NO+4H++4e-=N2+2H2O.
(2)若工业废水中的NO2-的浓度约为1.0×10-4 mol•L-1,取工业废水5mL 于试管中,滴加2滴0.1mol•L-1的硝酸银溶液,能否看到沉淀现象?试通过计算说明.(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol.请计算热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=-229KJ/mol
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
?已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.根据图中信息,如何说明水解反应速率随温度升
高而增大:25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.
16.碱金属元素具有相似的化学性质,是由于它们的原子具有相同的( )
| A. | 原子半径 | B. | 电子层数 | C. | 核外电子数 | D. | 最外层电子数 |
3.分子式为C9H11Cl芳香族化合物,其苯环上的一溴代物有两种,满足此条件的同分异构体有( )种.
| A. | 10 | B. | 11 | C. | 13 | D. | 14 |
13.有机物 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
20.能和对苯二甲酸发生缩聚反应的化合物是( )
| A. | 苯酚 | B. | 甲醛 | C. | 乙醇 | D. | 乙二醇 |
17.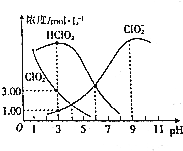 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
 亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂,在水溶液中可生成Cl02、HClO2、ClO2-、Cl-等,经测定,25℃时某浓度的NaClO2溶液中各组分含量随pH变化情况如图所示(Na+、Cl-没有画出).下列有关该溶液的说法不正确的是( )| A. | 亚氯酸钠在碱性条件下较稳定 | |
| B. | HClO2的电离平衡常数Ka=10-6 | |
| C. | pH=3时,c(Cl-)>c(ClO2-) | |
| D. | pH=4时,c(Cl-)+c(ClO2-)-c(Na+)=10-4-10-10 |
20.“玉兔”号月球车用${\;}_{94}^{238}$Pu作为热源材料.下列关于${\;}_{94}^{238}$Pu的说法正确的是( )
| A. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U互为同位素 | |
| B. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的最外层电子数 | |
| C. | ${\;}_{94}^{238}$Pu与${\;}_{94}^{239}$Pu具有相同的中子数 | |
| D. | ${\;}_{94}^{238}$Pu与${\;}_{92}^{238}$U具有完全相同的化学性质 |