题目内容
5.下列各组混合物,能用分液的方法分离的是( )| A. | 氯化钠和泥沙 | B. | 汽油和柴油 | C. | 四氯化碳和水 | D. | 氯化钙和硫酸钡 |
分析 根据分液漏斗可以将互不相溶的两层液体分开,则分析选项中物质的溶解性即可.
解答 解:A.氯化钠和泥沙,泥沙不溶于水,氯化钠易溶于水,用过滤的方法分离,所以不能用分液漏斗分离,故A错误;
B.汽油和柴油能互溶,所以不能用分液漏斗分离,故B错误;
C.水和四氯化碳不溶,所以能用分液漏斗分离,故C正确;
D.硫酸钡难溶于水,氯化钙易溶于水,用过滤的方法分离,所以不能用分液漏斗分离,故D错误.
故选C.
点评 本题考查物质的分离,题目难度不大,本题注意把握常见混合物的分离原理、方法以及操作的注意事项等.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
15.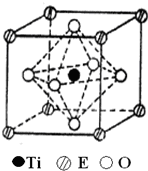 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:H-C≡C-H.
(2)写出E元素的元素符号:Co,其价电子排布图为: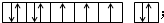 .
.
(3)A与D形成化合物的化学式为BCl3,是非极性分子(填“极性”或“非极性”)
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为6个、12个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为直线形,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是NH3和N3-,E的配位数是6.
 A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(2)写出E元素的元素符号:Co,其价电子排布图为:
 .
.(3)A与D形成化合物的化学式为BCl3,是非极性分子(填“极性”或“非极性”)
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为6个、12个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为直线形,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是NH3和N3-,E的配位数是6.
16.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂.下列说法正确的是( )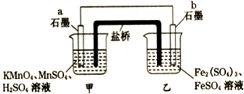

| A. | b电极上发生的反应:Fe2+-e-═Fe3+ | |
| B. | a电极上发生氧化反应:MnO4-+8H++5e-═Mn2++4H2O | |
| C. | 外电路电子的流向是从a到b | |
| D. | 电池工作时,盐桥中的SO42-移向甲烧杯 |
20.化学中将具有的原子数相同、最外层电子数之和相同的粒子称为等电子体.下列各组中的物质属于等电子体的是( )
| A. | CN-和N2 | B. | NO和O2 | C. | NO2和CO2 | D. | SO2和ClO2 |
10.下列元素中,化学性质最活泼的是( )
| A. | 硅 | B. | 磷 | C. | 硫 | D. | 氯 |
17.甲醛的分子式为CH2O,常温下是气体,有毒.下列分析正确的是( )
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
15.某同学在实验报告中有以下实验数据记录,其中合理的是( )
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |

 .
.