题目内容
11.在亚硝酸钠(NaNO2)中氮元素的化合价为+3价.为证明和研究亚硝酸钠的性质.现有下列几种试剂可供选择:①KMnO4溶液.②稀H2SO4溶液.③稀HNO3溶液.④稀NaOH溶液.⑤淀粉、KI溶液.(注:NaNO2的还原产物为NO).试用上述试剂回答下列各问:
(1)证明NaNO2具有氧化性应选择的试剂是②⑤,发生反应的离子方程式是4H++2NO2-+2I-=2NO↑+I2+2H2O
(2)证明NaNO2具有还原性应选择的试剂是①②,发生反应的离子方程式是16H++2MnO4-+10I-=2Mn2++5I2+8H2O.
分析 (1)说明 NO2-有氧化性,则N元素的化合价降低,与还原剂KI反应即可;
(2)说明 NO2-有还原性,则N元素的化合价升高,与氧化剂KMnO4反应即可.
解答 解:在酸性条件下,亚硝酸根(NO2-)的还原产物为 NO,氧化产物为 NO3-,
(1)说明 NO2-有氧化性,则N元素的化合价降低,与还原剂KI反应,选择的试剂为②⑤,现象为生成无色气体又变为红棕色,发生的离子反应为4H++2NO2-+2I-=2NO↑+I2+2H2O,
故答案为:②⑤;4H++2NO2-+2I-=2NO↑+I2+2H2O;
(2)说明 NO2-有还原性,则N元素的化合价升高,与氧化剂KMnO4反应,选择试剂为①②,现象为高锰酸钾溶液褪色,发生的离子反应为16H++2MnO4-+10I-=2Mn2++5I2+8H2O,
故答案为:①②;16H++2MnO4-+10I-=2Mn2++5I2+8H2O.
点评 本题考查氧化还原反应及物质的检验,为高频考点,把握习题中的信息及氧化剂与还原剂的反应为解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
1.标准状况下的下列气体关系正确的是( )
①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3.
①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3.
| A. | 体积:④>①>②>③ | B. | 密度:②>③>①>④ | ||
| C. | 质量:②>③>①>④ | D. | 氢原子数:①>②>③>④ |
2.下列物质中,长期露置在空气中,不会变质的是( )
| A. | 硫酸亚铁 | B. | 氯水 | C. | 食盐 | D. | 漂白粉 |
16.下列表示对应化学反应的离子方程式正确的是( )
| A. | 氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| B. | 向10mL1mol/LNa2CO3溶液中逐滴加入5mL1mol/L盐酸:2H++CO${\;}_{3}^{2-}$═CO2↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O═HSO${\;}_{3}^{-}$+NH${\;}_{4}^{+}$ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO${\;}_{3}^{-}$═Ag++NO↑+H2O |
3.下列有关化学方程式或离子方程式正确的是( )
| A. | 将氯气、铁按n(Cl2):n(Fe)=5:4混合点燃:5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl3+2FeCl2 | |
| B. | 将0.5molN2和1.5molH2于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 将大理石粉末置于FeCl3溶液中有气泡产生:2Fe3++3H2O+3CaCO3═2Fe(OH)3↓+3CO2↑+3Ca2+ | |
| D. | 将浓度均为0.1mol•L-1的NaOH、NH4HCO3等体积混合:NH4++OH-═NH3•H2O |
15.下列各原子或离子的电子排布式错误的是( )
| A. | Ca2+1s22s22p63s23p6 | B. | O2-1s22s22p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar1s22s22p63s23p6 |
16.硅被誉为无机非金属材料的主角,硅单质可用来制作( )
| A. | 陶瓷餐具 | B. | 石英表 | C. | 计算机芯片 | D. | 光导纤维 |
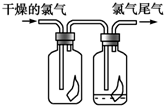 (1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.
(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是干燥的有色布条无明显现象,潮湿的有色布条褪色.