题目内容
16.硅被誉为无机非金属材料的主角,硅单质可用来制作( )| A. | 陶瓷餐具 | B. | 石英表 | C. | 计算机芯片 | D. | 光导纤维 |
分析 硅位于金属和非金属分界线附近,常用作半导体材料,为无机非金属材料的主角,而二氧化硅具有熔点高、硬度大的特点,常用于制备耐高温材料和光导纤维.
解答 解:A、陶瓷餐具的原料为二氧化硅,不是单质硅,故A错误;
B、石英钟表的构成材料为二氧化硅,不是单质硅,故B错误;
C、计算机芯片的主要成分为单质硅,故C正确;
D、光导纤维的主要成分为二氧化硅构,不是单质硅,故D错误.
故选:C.
点评 本题主要考查硅及其化合物的性质与应用,题目难度不大,注意基础知识的积累.

练习册系列答案
相关题目
8.下列说法正确的是( )
| A. | 40K和40Ca原子中的质子数和中子数都相等 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 几种核素具有相同的核电荷数,一定是同种原子 | |
| D. | 同种元素的不同核素之间互称同位素 |
5.表是元素周期表的一部分,根据所给的10种元素,完成以下各小题.
(1)镁的原子结构示意图为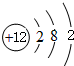 .
.
(2)H2SO4与HClO4中,酸性较强的是HClO4.
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是Al(OH)3,它常用作治疗胃酸(含盐酸)过多的药物,该反应的化学方程式为Al(OH)3+3HCl═AlCl3+3H2O.
(4)碳元素形成的一种氧化物的化学式是CO或CO2,该物质中C元素与O元素的质量比为3:4(或3:8).(相对原子质量:C-12 O-16)
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
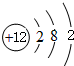 .
.(2)H2SO4与HClO4中,酸性较强的是HClO4.
(3)NaOH与Al(OH)3中,属于两性氢氧化物的是Al(OH)3,它常用作治疗胃酸(含盐酸)过多的药物,该反应的化学方程式为Al(OH)3+3HCl═AlCl3+3H2O.
(4)碳元素形成的一种氧化物的化学式是CO或CO2,该物质中C元素与O元素的质量比为3:4(或3:8).(相对原子质量:C-12 O-16)

 两种有机物的结构简式
两种有机物的结构简式 ;
; .
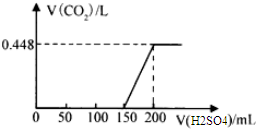
.
 如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.
如图所示,将铁、铜通过导线相连,置于硝酸银溶液中.