题目内容
6.已知短周期元素W,X,Y,Z,M的原子序数依次增大,若X原子的内层电子数与外层电子数之比为1:2,Z原子的最外层电子数是内层电子数的3倍,W+和Z2-的电子数之差为8,M原子次外层电子数的是最外层电子数的4倍,则:(1)W,X,Y,Z,M分别代表的元素为:锂,碳,氮,氧,镁(用元素名称表示.)
(2)W+的结构示意图:
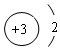 .
.(3)以上元素和Z形成的离子化合物有MgO、Li2O(写化学式):以上元素能和Z形成共价化合物的有碳、氮(写元素名称).
(4)Y和M形成的化合物为离子化合物(填“离子”或“共价”),化学式为Mg3N2.
分析 短周期元素W、X、Y、Z、M的原子序数依次增大,若X原子的内层电子数与外层电子数之比为1:2,Z原子的最外层电子数是内层电子数的3倍,由于最外层电子数不超过8,则X、Y均原子只能有2个电子层,X、Y最外层电子数分别为4、6,故X为碳元素、Z为氧元素;Y的原子序数介于碳、氧之间,故Y为氮元素;W+和Z2-的电子数之差为8,可推知W为Li元素;M原子次外层电子数的是最外层电子数的4倍,可推知M为Mg.
解答 解:(1)短周期元素W、X、Y、Z、M的原子序数依次增大,若X原子的内层电子数与外层电子数之比为1:2,Z原子的最外层电子数是内层电子数的3倍,由于最外层电子数不超过8,则X、Y均原子只能有2个电子层,X、Y最外层电子数分别为4、6,故X为碳元素、Z为氧元素;Y的原子序数介于碳、氧之间,故Y为氮元素;W+和Z2-的电子数之差为8,可推知W为Li元素;M原子次外层电子数的是最外层电子数的4倍,可推知M为Mg,
故答案为:锂;碳;氮;氧;镁;
(2)Li+的结构示意图: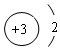 ,故答案为:
,故答案为: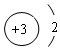 ;
;
(3)以上元素和氧形成的离子化合物有MgO、Li2O,以上元素能和氧形成共价化合物的有碳元素、氮元素,故答案为:MgO、Li2O;碳、氮;
(4)Y和M形成的化合物为Mg3N2,属于离子化合物,故答案为:离子;Mg3N2.
点评 本题考查原子结构、核外电子排布、元素化合物知识,关键是根据核外电子排布规律推断元素,注意对基础知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为 ;
;
(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na;
(5)在 ⑦与 ⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)化学性质最不活泼的元素是Ar,其原子的原子结构示意图为
 ;
;(3)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(4)在③~⑦元素中,原子半径最大的是Na;
(5)在 ⑦与 ⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.
15.区别固体Na2CO3和NaHCO3最好的方法是( )
| A. | 加澄清的石灰水 | B. | 两者分别与同浓度的稀盐酸反应 | ||
| C. | 溶于水,比较其溶解性 | D. | 两者分别加入NaOH溶液 |

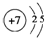 .
. .
.
 ,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).
,则其中铝原子的杂化方式为sp2.若氮化铝可由(CH3)3Al 和 NH3在一定条件下反应制得,反应的方程式为:(CH3)3Al+NH3$\frac{\underline{\;一定条件\;}}{\;}$AlN+3CH4 ,该反应与取代反应有机反应类型相似(填反应名称).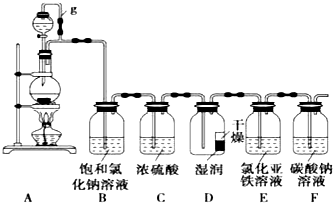 某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题:
某探究小组为探究氯气的性质,并用装置F制取少量“漂白液”,设计了如下实验装置.请回答下列问题: