题目内容
①CaCO3(s)═CaO+CO2(g)△H=177.7kJ/mol
②2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ
③0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l)△H=-57.3kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+1/2O2(s)═CO2(g)△H=-283kJ/mol
⑥HNO3 (aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
(1)上述热化学方程式中,共有 个不正确的,并分别指明不正确的理由 ;
(2)根据上述信息,写出C转化为CO的热化学方程式 .
(3)上述反应中,表示燃烧热的热化学方程式有 ;表示中和热的热化学方程式有 .
②2H2(g)+O2(g)═2H2O(l)△H=-517.6kJ
③0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l)△H=-57.3kJ/mol
④C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
⑤CO(g)+1/2O2(s)═CO2(g)△H=-283kJ/mol
⑥HNO3 (aq)+NaOH(aq)═NaNO3(aq)+H2O(l)△H=-57.3kJ/mol
(1)上述热化学方程式中,共有
(2)根据上述信息,写出C转化为CO的热化学方程式
(3)上述反应中,表示燃烧热的热化学方程式有
考点:用盖斯定律进行有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)①CaO的状态没有标,△H的+号没标;②反应热的单位是kJ/mol;③除H2O外其余物质应改为aq;
(2)根据盖斯定律,④-⑤得C(s)+
O2(g)=CO2(g)△H;
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热;稀溶液中,酸和碱发生中和反应生成1mol水放出的热量叫做中和热.
(2)根据盖斯定律,④-⑤得C(s)+
| 1 |
| 2 |
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热;稀溶液中,酸和碱发生中和反应生成1mol水放出的热量叫做中和热.
解答:
解:(1)①CaO的状态没有标,△H的+号没标;②反应热的单位是kJ/mol;③除H2O外其余物质应改为aq;④⑤⑥都正确,
故答案为:3;①CaO的状态没有标,△H的+号没标,②反应热的单位是kJ/mol,③除H2O外其余物质应改为aq;
(2)根据盖斯定律,④-⑤得C(s)+
O2(g)=CO2(g)△H=-393.5kJ/mol+283kJ/mol=-110.5kJ/mol,
故答案为:C(s)+
O2(g)=CO2(g)△H=-110.5kJ/mol;
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热,上述反应中,④⑤分别是表示C、CO燃烧热的热化学方程式;
稀强酸和稀强碱反应生成1mol水所放出的热量为中和热,上述反应中⑥为中和热的热化学方程式.
故答案为:④⑤;⑥.
故答案为:3;①CaO的状态没有标,△H的+号没标,②反应热的单位是kJ/mol,③除H2O外其余物质应改为aq;
(2)根据盖斯定律,④-⑤得C(s)+
| 1 |
| 2 |
故答案为:C(s)+
| 1 |
| 2 |
(3)1mol物质完全燃烧生成稳定氧化物放出的热量为燃烧热,上述反应中,④⑤分别是表示C、CO燃烧热的热化学方程式;
稀强酸和稀强碱反应生成1mol水所放出的热量为中和热,上述反应中⑥为中和热的热化学方程式.
故答案为:④⑤;⑥.
点评:本题考查学生热化学方程式的书写方法以及盖斯定律计算化学反应的焓变等知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
在元素周期表中碳元素的信息如图所示,下列说法正确的是( )


| A、碳原子中的质子数为6 |
| B、碳的相对原子质量是12.01g |
| C、碳属于金属元素 |
| D、碳的氧化物只有一种 |
已知反应:
①2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1
下列结论错误的是( )
①2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1
②H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1
下列结论错误的是( )
| A、碳的燃烧热大于110.5kJ?mol-1 |
| B、①的反应热为-221kJ?mol-1 |
| C、稀醋酸和稀NaOH溶液反应生成1molH2O,放出57.3 kJ的热量 |
| D、稀H2SO4 和稀NaOH溶液反应的中和热为57.3 kJ?mol-1 |
下列说法正确的是( )
| A、在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B、一定温度下,含AgCl固体的某溶液中,一定有c(Ag+)=c(Cl-) |
| C、一定温度下,当溶液中Ag+和Cl-浓度的乘积等于Ksp值时,此溶液一定为AgCl的饱和溶液 |
| D、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
 -COOH.A、B、C、D、E的相互转化关系如图所示:
-COOH.A、B、C、D、E的相互转化关系如图所示: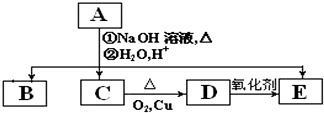


 在一定条件下可水解为
在一定条件下可水解为 和R2-NH2.H在一定条件下水解的产物之一为氨基酸M,则由M形成二肽的化学方程式为
和R2-NH2.H在一定条件下水解的产物之一为氨基酸M,则由M形成二肽的化学方程式为 某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质.请回答下列问题: