题目内容
18.下列有关胶体的叙述正确的是( )| A. | 将饱和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3胶体 | |
| B. | 胶体区别于其它分散系的本质特征是胶体粒子的直径大小 | |
| C. | 用过滤的方法可以分离和提纯胶体 | |
| D. | 煮鸡蛋的过程中发生了胶体的电泳现象 |
分析 A.氯化铁水解为吸热过程,加热有利于水解正向进行;
B.胶体本质特征分散质粒度介于1-100nm;
C.胶体分散质粒度小于滤纸孔径;
D.煮鸡蛋为胶体变性的过程.
解答 解:A.将饱和FeCl3溶液滴加入沸水中直接就能制得Fe(OH)3胶体,故A错误;
B.胶体区别于其它分散系的本质特征是胶体粒子的直径大小,故B正确;
C.胶体分散质粒度小于滤纸孔径,大于半透膜孔径,不能用过滤法提纯胶体,应用渗析法提纯,故C错误;
D.煮鸡蛋为胶体变性的过程,故D错误;
故选:B.
点评 本题考查了胶体的性质,明确胶体的本质特征为分散质粒度大小,熟悉胶体据此、电泳的性质,熟悉氢氧化铁胶体制备原理是解题关键,题目难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
9.某兴趣小组欲通过实验方法验证Fe2+的某些性质.
(1)在实验前,依据Fe2+的还原性,填写了如表.
依照表中操作,该小组进行实验.观察到液面上方气体逐渐变为红棕色,但试管中溶液颜色却变为深棕色.
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
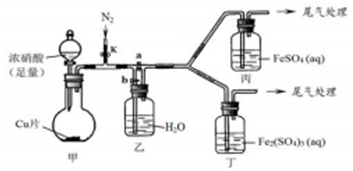
(4)该小组用如图装置进行探究:
(5)结合实验猜想,得出结论:
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
(1)在实验前,依据Fe2+的还原性,填写了如表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
(4)该小组用如图装置进行探究:

| 步骤 | 操作及现象 | 解释或结论 |
| ① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由Fe2+与NO或NO2反应而的得到 |
| ② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的排净乙装置及导气管中的NO2 |
| ③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为3NO2+H2O=2HNO3+NO |
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
6.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 在常温常压下,11.2 L O2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氦气含有的原子数为2NA | |
| C. | 71 g Cl2所含原子数为2NA | |
| D. | 标准状况下,1 mol H2O和1 mol H2的体积都约为22.4 L |
10.现要配置一定物质的量浓度的100mL1mol•L-1NaOH溶液,下列操作正确的是( )
| A. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
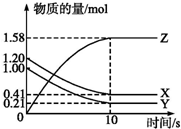 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: