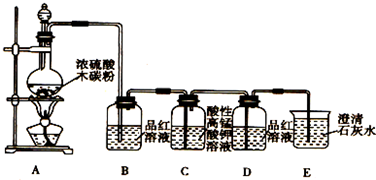
题目内容
3.SO2是造成空气污染的主要原因之一,利用钠碱循环法可除去SO2.(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是SO32-+SO2+H2O=2HSO3-.
(2)已知常温下,H2SO3的电离常数为 K1=1.54×10-2,K2=1.02×10-7,H2CO3的电离常数为 K1=4,.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是bc (选填编号).
a.CO32-HSO3-b.HCO3-HSO3-c.SO32-HCO3-d.H2SO3HCO3-
(3)已知NaHSO3溶液显酸性,解释原因亚硫酸氢根的电离程度大于水解程度,在NaHSO3稀溶液中各离子浓度从大到小排列顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-).
(4)实验发现把亚硫酸氢钠溶液放置在空气中一段时间,会被空气中的氧气氧化,写出该反应的离子方程式2HSO3-+O2=2SO42-+2H+.
(5)在NaIO3溶液中滴加过量NaHSO3溶液,反应完全后,推测反应后溶液中的还原产物为NaI (填化学式).
分析 (1)SO2被Na2SO3溶液吸收生成亚硫酸氢钠;
(2)根据Ka越大酸性越强,根据酸性较强的能与酸性较弱的酸根离子反应;
(3)根据电离和水解程度的相对大小分析;既电离又水解,以电离为主,溶液显酸性;
(4)+4价的硫元素能被氧气氧化为+6价;
(5)根据过量NaHSO3溶液的还原性和I2的氧化性能继续发生氧化还原反应来分析反应产物.
解答 解:(1)SO2被Na2SO3溶液吸收生成亚硫酸氢钠,离子反应为SO32-+SO2+H2O=2HSO3-,
故答案为:SO32-+SO2+H2O=2HSO3-;
(2)已知Ka越大酸性越强,酸性较强的能与酸性较弱的酸根离子反应,由于HCO3-的酸性小于HSO3-的酸性,所以HCO3-与SO32-不反应,即bc能共存,
故答案为:bc;
(3)HSO3 -在溶液中电离出氢离子,同时HSO3 -能水解,由于电离程度大于水解程度,所以溶液显酸性;HSO3 -既电离又水解,以电离为主,溶液显酸性,则溶液中的离子浓度大小关系为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:亚硫酸氢根的电离程度大于水解程度;c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(4)+4价的硫元素能被氧气氧化为+6价,则亚硫酸氢钠溶液放置在空气中一段时间,会被空气中的氧气氧化,其反应的离子方程式为:2HSO3-+O2=2SO42-+2H+,
故答案为:2HSO3-+O2=2SO42-+2H+;
(5)NaIO3溶液中滴加过量NaHSO3溶液时,I2能与NaHSO3发生氧化还原反应,碘元素的化合价降低,则还原产物为NaI,
故答案为:NaI;
点评 本题考查了寒流物质的性质,反应离子方程式书写、盐类水解应用、电解质溶液中离子浓度大小比较、氧化还原反应等知识点,掌握基础是解题关键,题目难度中等.

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案| A. | 增加A的量,平衡正向移动,达到新平衡时K值增大 | |
| B. | 升高温度,K值增大 | |
| C. | K越大,说明该反应的进行程度越大 | |
| D. | 该反应的K=$\frac{{c}^{m}(A)+cn(B)}{{c}^{p}(C)+{c}^{q}(D)}$ |
| A. | 将饱和FeCl3溶液滴加入冷水中直接就能制得Fe(OH)3胶体 | |
| B. | 胶体区别于其它分散系的本质特征是胶体粒子的直径大小 | |
| C. | 用过滤的方法可以分离和提纯胶体 | |
| D. | 煮鸡蛋的过程中发生了胶体的电泳现象 |
①SO2 ②NH4Cl溶液 ③NaHSO4溶液 ④醋酸溶液
⑤NaNO3溶液 ⑥氨水 ⑦NaHCO3溶液(溶液显碱性) ⑧NaOH溶液.
| A. | ①③④⑥⑧ | B. | ①④⑥⑧ | C. | ①④⑤⑥⑦ | D. | ②⑤⑧ |
 实验室制备乙酸正丁酯的化学方程式:
实验室制备乙酸正丁酯的化学方程式:CH3COOH+CH3CH2CH2OH$?_{△}^{H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O
制备过程中还可能的副反应有:
CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2CH2CH2CH3+H2O
主要实验步骤如下:
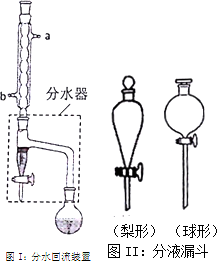
①在干燥的圆底烧瓶中加11.5mL正丁醇、7.2mL冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再如图Ⅰ装置安装好分水器、冷凝管.然后小火加热.
②将烧瓶中反应后的混后物冷却与分水器中的酯层合并,转入分液漏斗,
③依次用10mL水,10mL 10%碳酸钠溶液洗至无酸性(pH=7),再水洗一次,用少许无水硫酸镁干燥.
④将干燥后的乙酸正丁酯转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品.主要试剂及产物的物理常数:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度(g•cm-3) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点(℃) | 118.0 | 118.1 | 126.1 | 142 |
(1)图I装置中冷水应从b(填a或b),管口通入,反应混合物冷凝回流,通过分水器下端旋塞分出的生成物是水,其目的是分离酯化反应生成的水,使平衡正向移动,提高反应产率.
(2)在步骤①④中都用到沸石防暴沸,下列关于沸石的说法正确的是AD.
A.实验室沸石也可用碎瓷片等代替
B.如果忘加沸石,可速将沸石加至将近沸腾的液体中
C.当重新进行蒸馏时,用过的沸石可继续使用
D.沸石为多孔性物质,可使液体平稳地沸腾
(3)在步骤③分液时,应选择图II装置中梨形分液漏斗,其原因是梨形分液漏斗靠近旋塞处比较细长,双液界面更清晰,分离更完全.
(4)在提纯粗产品的过程中,用碳酸钠溶液洗涤主要除去的杂质乙酸、硫酸、正丁醇.若改用氢氧化钠溶液是否可以不可以(填“可以”或“不可以”),其原因用氢氧化钠溶液会使乙酸正丁酯发生水解.
(5)步骤④的常压蒸馏,需收集126.1℃的馏分,沸点大于140℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是防止因温差过大,冷凝管炸裂.