题目内容
2.下列离子方程式中,正确的是( )| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
分析 A.氢氧化钠过量,氢氧化镁比碳酸镁更难溶,反应生成氢氧化镁沉淀;
B.氯气足量,二价铁离子、溴离子都被氧化;
C.二氧化碳与碳酸钠溶液反应生成碳酸氢钠;
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,说明SO42-与Ba2+的比例是1:2.
解答 解:A.Mg(HCO3)2溶液与足量的NaOH溶液,反应生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O,故A错误;
B.溴化亚铁溶液中通入足量的氯气,离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故B错误;
C.少量的CO2通入稀的碳酸钠溶液中,离子方程式:CO2+CO32-+H2O═2HCO3-,故C正确;
D.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀,离子方程式为:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确发生反应的实质及离子方程式书写方法是解题关键,注意化学式拆分、注意反应物用量对反应的影响,题目难度中等.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
12.X、Y两种元素均为短周期元素,X元素的原子所具有的电子层数为其最外层电子数的二分之一.下列有关判断中,正确的是( )
| A. | X元素在周期表中的位置只能是第二周期第ⅣA族 | |
| B. | 若X的常见简单阴离子Xn-能跟Y的单质发生氧化还原反应,则说明Y的非金属性比X的强 | |
| C. | 若Y的非金属性比X的强,则与同一种还原剂反应时,一个Y原子得到的电子数一定比一个X原子得到的电子数少 | |
| D. | 若X能形成XO32-、XO42-和X2O32-,Y能形成YO3-和XO4-,则X、Y一定在同一周期 |
7.分枝酸可用于生化研究,其结构简式如图.下列关于分枝酸的叙述正确的是( )
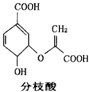

| A. | 可与乙醇、乙酸反应,且反应类型相同 | |
| B. | 1 mo1分枝酸最多可与3 mol NaOH发生中和反应 | |
| C. | 分枝酸的分子式为C10H8O6 | |
| D. | 分枝酸分子中含有2种官能团 |
11.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
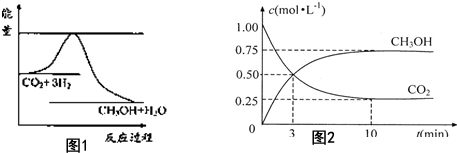 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)