题目内容
14.(1)用过量铜片与0.2mol浓H2SO4共热足够长时间(只考虑铜与浓H2SO4反应,忽略其他副反应),甲认为产生的SO2少于0.1mol,理由是由反应Cu+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O知,当0.2mol浓H2SO4全部反应时才生成0.1molSO2,随着反应进行,浓H2SO4变稀,不能与Cu反应,故甲认为少于0.1molSO2;;而乙同学认为产生的SO2为0.1mol,理由是乙同学认为稀H2SO4与铜反应由于加热时间足够长,水比H2SO4易挥发,因此,H2SO4始终保持较高浓度,直至与铜完全反应为止;.
(2)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的.铜屑在此状态下被溶解的化学方程式为2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
利用铜制备CuSO4的另一种方法可用化学方程式表示为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
以上两种方法前(填“前”或“后”)者好,原因是两种方法前者好因为不产生有污染的SO2气体,且生成等量的CuSO4.耗H2SO4少.
分析 (1)依据浓硫酸具有强的氧化性,能够与铜反应生成二氧化硫,稀硫酸不具有强的氧化性,不能与铜反应解答;
(2)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,铜与稀硫酸、氧气反应生成硫酸铜和水,依据生成物性质及消耗硫酸的量解得.
解答 解:(1)过量铜片与0.2mol H2SO4(浓)反应,理论上生成0.1mol SO2,但当浓H2SO4变稀时与Cu不反应,故甲认为少于0.1mol SO2;乙同学认为加热足够长时间,水挥发后,稀H2SO4又变成浓H2SO4,直至与Cu反应完全.
故答案为:由反应Cu+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O知,当0.2mol浓H2SO4全部反应时才生成0.1mol SO2,随着反应进行,浓H2SO4变稀,不能与Cu反应,故甲认为少于0.1mol SO2;
乙同学认为稀H2SO4与铜反应由于加热时间足够长,水比H2SO4易挥发,因此,H2SO4始终保持较高浓度,直至与铜完全反应为止;
(2)2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,若制得1mol CuSO4,第一种方法只需1mol H2SO4,而第二种方法则要用2mol H2SO4,而且生成的SO2会造成大气污染
故答案为:2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;前;两种方法前者好因为不产生有污染的SO2气体,且生成等量的CuSO4
点评 本题考查了元素化合物知识,熟悉浓硫酸的性质是解题关键,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 氢氧化钠溶液 | B. | 浓硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
| A. | 饱和Na2SO4溶液可以使蛋白质变性 | |
| B. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| C. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
| A. | 反应A(g)?2B(g)△H,若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,则△H=-(Ea-Eb)kJ•mol-1 | |
| B. | 某温度下,氯化钠在水中的溶解度是20g,则该温度下的饱和氯化钠溶液溶质的质量分数为20% | |
| C. | 将浓度为0.1 mol•L-1HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,$\frac{{c({F^-})}}{{c({H^+})}}$始终保持增大 | |
| D. | 将0.2 mol•L-1的CH3COOH溶液与0.1 mol•L-1的NaOH溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
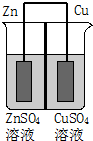 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )| A. | Zn2+通过隔膜从负极区向正极区移动 | |
| B. | 电子由Cu极通过导线流向Zn极 | |
| C. | 一段时间后ZnSO4溶液浓度增大CuSO4溶液浓度减小 | |
| D. | Cu2+与Zn2+物质的量之和保持不变 |
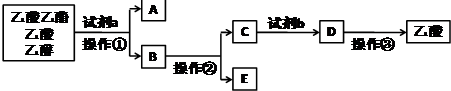
| A. | 操作①用到的玻璃仪器主要有分液漏斗、烧杯 | |
| B. | 工业制备无水E物质的方法是在E中加生石灰后进行操作② | |
| C. | 试剂b可用硫酸 | |
| D. | 操作③用到的仪器和用品主要有漏斗、烧杯、玻璃棒、滤纸 |