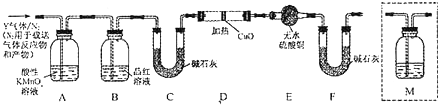
题目内容
11.用NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
分析 A、求出-OH的物质的量,然后根据-OH中含9个电子来分析;
B、乙烯和丙烯的最简式均为CH2;
C、标况下二氯甲烷为液态;
D、1mol乙烯和乙醇均消耗3mol氧气.
解答 解:A、1.7g-OH的物质的量为0.1mol,而-OH中含9个电子,故0.1mol-OH中含0.9mol电子即0.9NA个,故A错误;
B、乙烯和丙烯的最简式均为CH2,故42g混合物中含有的CH2的物质的量为n=$\frac{42g}{14g/mol}$=3mol,故含3NA个碳原子,故B正确;
C、标况下二氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、1mol乙烯和乙醇均消耗3mol氧气,故0.1mol乙烯和乙醇的混合物消耗0.3mol氧气即0.3NA个氧气分子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.下列离子方程式中,正确的是( )
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
19.25℃时,将某强酸和某强碱溶液按10:1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是( )
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
16.下列说法正确的是( )
| A. |  和 和 互为同系物 互为同系物 | |
| B. | 教材中做石蜡油分解实验和石油蒸馏实验都会用到碎瓷片,其作用是相同的 | |
| C. | 某烃的结构用键线式表示为 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 | |
| D. | 105℃,1.01×105Pa时,aL某气态烃在bL氧气(足量)中完全燃烧,将所得混合气体通过浓硫酸剩余气体cL,则烃燃烧生成的水蒸气的体积就是(a+b-c)L(气体体积在相同条件下测定) |
3. 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )| A. | Zn2+通过隔膜从负极区向正极区移动 | |
| B. | 电子由Cu极通过导线流向Zn极 | |
| C. | 一段时间后ZnSO4溶液浓度增大CuSO4溶液浓度减小 | |
| D. | Cu2+与Zn2+物质的量之和保持不变 |
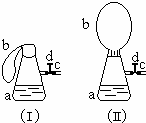 如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白: