题目内容
16.(1)将CO2气体持续通入澄清石灰水中,发现澄清石灰水先浑浊,后又变澄清,写出在该过程中所涉及的化学方程式:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+CaCO3+H2O=Ca(HCO3)2(2)Cu与浓硫酸反应的化学反应方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
其中在此反应中,硫酸体现了什么性质:酸性、氧化性
(3)海水提镁中,贝壳的作用是(用化学反应方程式表示):CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O=Ca(OH)2
(4)工业上制备粗硅的化学方程式是:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(5)SiO2是玻璃的成分之一,SiO2与氢氧化钠溶液反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O,工艺师常用氢氟酸(填物质名称)来雕刻玻璃.
(6)工业上常采用碳酸盐与石英为原料制取玻璃,请写出工业制取玻璃的化学反应方程式:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
分析 (1)少量二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,过量的二氧化碳和碳酸钙和水反应生成碳酸氢钙;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,硫酸体现酸性、氧化性;
(3)依据贝壳成分为碳酸钙,加热分解生成的氧化钙溶于水会生成沉淀镁离子所需的碱;
(4)工业上制备粗硅利用二氧化硅在高温下与碳反应生成单质硅和一氧化碳制取;
(5)在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O;氢氟酸能与玻璃反应生成四氟化硅气体;
(6)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳.
解答 解:(1)将CO2气体持续通入澄清石灰水中,发现澄清石灰水先浑浊,为少量二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应为:CO2+Ca(OH)2=CaCO3↓+H2O,后又变澄清,为过量的二氧化碳和碳酸钙和水反应生成碳酸氢钙,反应为:CO2+CaCO3+H2O=Ca(HCO3)2,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O、CO2+CaCO3+H2O=Ca(HCO3)2;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,硫酸中的硫从+6价降为+4价,体现氧化性,铜和酸反应生成硫酸铜,体现酸性,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;酸性、氧化性;
(3)海水提取镁要用到海滩的贝壳成分为碳酸钙,贝壳的作用是能转化为Ca(OH)2,可提供反应所需的碱,贝壳所经历的变化的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O=Ca(OH)2,
故答案为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+H2O=Ca(OH)2;
(4)工业上利用二氧化碳与碳在高温下反应生产晶体硅,反应的化学方程式为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(5)NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O:SiO2+2NaOH=Na2SiO3+H2O,氢氟酸与玻璃发生的反应为:4HF+SiO2=SiF4↑+2H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;氢氟酸;
(6)工业制玻璃主要原料有石英、纯碱和石灰石,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,该反应的化学方程式为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,
碳酸钙与二氧化硅在高温条件下反应生成硅酸钙和二氧化碳,该反应的化学方程式为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
故答案为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
点评 本题考查常见方程式的书写,该题是基础性试题的考查,属于识记性知识的检验,题目难度不大,有利于巩固学生的基础,提高学生的应试能力和规范答题能力.

| A. | 反应中转移电子的总数为0.3mol | |
| B. | 反应过程中,消耗硝酸的物质的量为0.3mol | |
| C. | 沉淀完全时消耗NaOH溶液的体积为100mL | |
| D. | 开始加入合金的质量可能为3.4g |
 碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、硼、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.(1)真空碳热还原-氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s)═6AlCl(g)+6CO(g)△H=a kJ•mol-1
②3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
反应:Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=0.5a+bkJ•mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
T1℃时,该反应的平衡常数=0.25.
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)AD
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
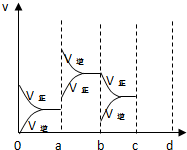
(3)如图表示在密闭容器中反应2SO2+O2?2SO3达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况.
①ab过程中改变的条件可能是:升高温度.
②bc过程中改变的条件可能是:降低产物SO3浓度.
③若增大压强时,反应速率变化情况画在c~d处.
| A. | NaOH溶液 | B. | 氨水 | C. | AgNO3溶液 | D. | KSCN溶液 |
| 物质 | 外观 | 在空气中加热时的现象 | 产物水溶液的酸碱性 |
| X | 黑色粉未 | 燃烧时呈炽红色并发出火花,放出无色气体G | 微弱酸性 |
| Y | 淡黄色晶体 | 首先熔化,然后燃烧,火焰为浅蓝色,放出有刺激性气味的气体 | 弱酸性 |
| Z | 银白色固体 | 燃烧,产生黄色火焰,生成浅黄色固体F | 强碱性 |
(2)G中的化学键有(填“有”或“没有”)极性.G在固态时属于分子晶体
(3)Y和Z直接作用后的生成物属于离子晶体.写出它的电子式
 .
. | A. | 使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 | |
| B. | 金属钠着火时不能使用泡沫灭火器灭火 | |
| C. | 因为NH4Cl受热易分解,实验室应保存在棕色试剂瓶中 | |
| D. | 铁粉作食品袋内的脱氧剂,起还原作用 |
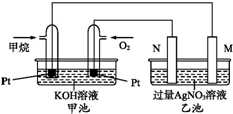 如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.
如图是一个甲烷燃料电池工作时的示意图.M、N两电极的质量相同,其中一个为银电极一个为铁电极.
 ;
;