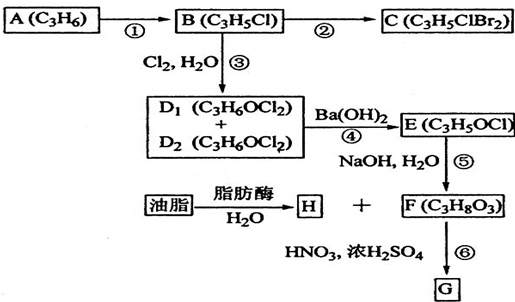
题目内容
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍关注
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.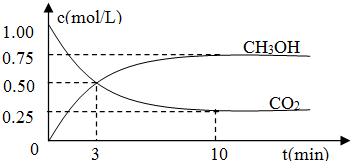
①从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L?min).氢气的转化率为 .
②下列措施中能使
增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g)?CH3OH(g)△H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,则平衡 ;
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断
作出此判断的理由是 .
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中能使
| n(CH3OH) |
| n(CO2) |
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)工业上也可以用CO和H2合成甲醇,反应原理为:CO(g)+2H2(g)?CH3OH(g)△H=-128.8kJ/mol,在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,则平衡
A.向正反应方向移动 B.向逆反应方向移动 C.不移动 D.无法判断
作出此判断的理由是
考点:物质的量或浓度随时间的变化曲线,化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)①根据v=
计算氢气反应速率,根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
②要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)根据浓度对平衡的影响判断.
| △c |
| △t |
②要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动;
(2)根据浓度对平衡的影响判断.
解答:
解:(1)①利用三段式解题法计算
CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
=0.225 mol?L-1?min-1,
氢气的转化率=
=75%,
故答案为:0.225;75%;
②要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD;
(2)在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,体积变大时CH3OH、CO的浓度成成比例减小,所以
的值不变等于K的值,即平衡不移动,故选C,
故答案为:C;K=
,CH3OH、CO成比例减小,c(H2)不变,则K不变.
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=
| 2.25mol/L |
| 10min |
氢气的转化率=
| 2.25 |
| 3 |
故答案为:0.225;75%;
②要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.将H2O(g)从体系中分离,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
D.再充入1mol CO2和3mol H2,等效于在原来基础上缩小体积一半,压强增大,平衡向正反应方向移动,则n(CH3OH)/n(CO2)增大,故D正确.
故答案为:CD;
(2)在温度不变的情况下,若在增大容器体积的同时不断充入氢气,使H2的浓度保持不变,体积变大时CH3OH、CO的浓度成成比例减小,所以
| c(CH3OH) |
| c(CO)c2(H2) |
故答案为:C;K=
| c(CH3OH) |
| c(CO)c2(H2) |
点评:本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度较大,尤其是第(2)问题根据平衡常数判断平衡移动,对学生的思维能力要求较高.

练习册系列答案
 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
相关题目
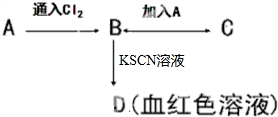 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系.
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,B溶液呈现黄色,C的溶液呈现浅绿色,A、B、C、D之间有如图所示转化关系. 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.