题目内容
(1)写出下列物质在水溶液中发生水解的离子方程式:
Na2CO3 ,KAl(SO4)2
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+
O2(g)═Cu2O(s)△H=-169kJ?mol-1,
C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1,
2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
Na2CO3
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为
考点:离子方程式的书写,热化学方程式
专题:离子反应专题
分析:(1)碳酸钠属于强碱弱酸盐,碳酸根离子为多元弱酸的酸根离子分步水解,以第一步为主;硫酸铝为强酸弱碱盐,铝离子为弱碱阳离子水解生成氢氧化铝和硫酸;
(2)依据盖斯定律将已知的热化学方程式变形计算得到所需热化学方程式.
(2)依据盖斯定律将已知的热化学方程式变形计算得到所需热化学方程式.
解答:
解:(1)碳酸根离子水解的离子方程式为:CO32-+H2O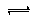 HCO3-+OH-;
HCO3-+OH-;
铝离子水解的离子方程式为:Al3++3H2O Al(OH)3+3H+,
Al(OH)3+3H+,
故答案为:CO32-+H2O HCO3-+OH-; Al3++3H2O
HCO3-+OH-; Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;
(2)①2Cu(s)+
O2(g)═Cu2O(s)△H=-169kJ?mol-1,
②C(s)+
O2(g)═CO(g)△H=-110.5kJ?mol-1,
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
依据盖斯定律②+①-③得到C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ?mol.-1;
故答案为:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ?mol.-1.
 HCO3-+OH-;
HCO3-+OH-;铝离子水解的离子方程式为:Al3++3H2O
 Al(OH)3+3H+,
Al(OH)3+3H+,故答案为:CO32-+H2O
 HCO3-+OH-; Al3++3H2O
HCO3-+OH-; Al3++3H2O Al(OH)3+3H+;
Al(OH)3+3H+;(2)①2Cu(s)+
| 1 |
| 2 |
②C(s)+
| 1 |
| 2 |
③2Cu(s)+O2(g)═2CuO(s)△H=-314kJ?mol-1
依据盖斯定律②+①-③得到C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ?mol.-1;
故答案为:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ?mol.-1.
点评:本题考查了盐类水解离子方程式的书写,利用盖斯定律求反应热,题目难度不大,注意盐类的水解是微弱的一般用可逆号,多元弱酸酸根离子分步水解,多元弱碱阳离子水解一步写到位;利用盖斯定律计算反应热的关键在于把握已知方程式和目标方程式的关系.

练习册系列答案
相关题目
 如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解.
如图所示,烧杯甲中放100mL6mol/L的盐酸溶液,烧杯乙中放入100mL冷水.现向烧杯甲的溶液中放入25gNaOH溶液固体,同时向乙烧杯中放入NH4NO3固体,搅拌使之溶解. I、已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.0kJ?mol-1
I、已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.0kJ?mol-1