题目内容
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)X、Y、Z、W四种元素的符号:X 、Y 、Z 、W
(2)X单质和Y单质的反应是工业固氮的主要方法,写出他们反应的化学方程式
(3)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 .
(1)X、Y、Z、W四种元素的符号:X
(2)X单质和Y单质的反应是工业固氮的主要方法,写出他们反应的化学方程式
(3)由X、Y、Z所形成的离子化合物是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Z原子最外层电子数是次外层电子数的3倍,Z原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y的氢化物分子中有3个共价键,原子序数小于O元素,则Y应为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,W原子质子数=5+6=11,则W为Na元素,X、W同主族,且X原子序数最小,结合四元素是连续三个不同短周期的元素,则X为H元素,据此解答.
解答:
解:Z原子最外层电子数是次外层电子数的3倍,Z原子只能有2个电子层,最外层电子数为6,则Z为O元素;Y的氢化物分子中有3个共价键,原子序数小于O元素,则Y应为N元素;W原子的质子数等于Y、Z原子最外层电子数之和,W原子质子数=5+6=11,则W为Na元素,X、W同主族,且X原子序数最小,结合四元素是连续三个不同短周期的元素,则X为H元素,
(1)由以上分析可知,X为H,Y为N、Z为O、W为Na,故答案为:H;N;O;Na;
(2)氢气与氮气反应生成氨气是工业固氮的主要方法,反应的化学方程式为:N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
(3)由H、N、O所形成的常见离子化合物为NH4NO3,W的最高氧化物的水化物为NaOH,二者反应的离子方程式为NH4++OH-
NH3↑+H2O,
故答案为:NH4NO3;NH4++OH-
NH3↑+H2O.
(1)由以上分析可知,X为H,Y为N、Z为O、W为Na,故答案为:H;N;O;Na;
(2)氢气与氮气反应生成氨气是工业固氮的主要方法,反应的化学方程式为:N2+3H2
| ||
| 高温高压 |
| ||
| 高温高压 |
(3)由H、N、O所形成的常见离子化合物为NH4NO3,W的最高氧化物的水化物为NaOH,二者反应的离子方程式为NH4++OH-
| ||
故答案为:NH4NO3;NH4++OH-
| ||
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重对基础知识的巩固,比较基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
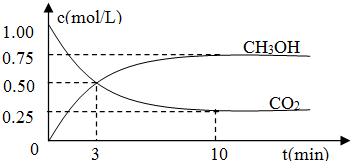
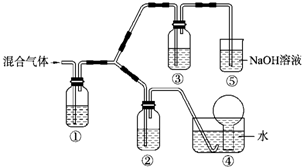 (一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
