题目内容
某同学欲探究食盐中所加碘的存在形式. 实验室可提供以下药品:淀粉、食盐、H2O2、NaI、HCl.
(1)该同学要选择哪几样药品,方可完成实验 ;
(2)写出反应的离子方程式,并用双线桥来表示电子转移 ;
(3)在该反应中,氧化剂是 ,还原剂是 ;
(4)能够观察到的明显现象为 ,氧化产物和还原产物的物质的量之比为 .
(1)该同学要选择哪几样药品,方可完成实验
(2)写出反应的离子方程式,并用双线桥来表示电子转移
(3)在该反应中,氧化剂是
(4)能够观察到的明显现象为
考点:氧化还原反应
专题:
分析:食盐中的碘以NaIO3形成存在,具有氧化性,在酸性条件下可与NaI发生氧化还原反应生成碘单质,可使淀粉变蓝,以此可进行检验,结合元素化合价的变化解答该题.
解答:
解:(1)食盐中的碘以NaIO3形成存在,具有氧化性,在酸性条件下可与NaI发生氧化还原反应生成碘单质,可使淀粉变蓝,则需要的药品有淀粉、食盐、NaI、HCl,
故答案为:淀粉、食盐、NaI、HCl;
(2)反应中只有碘元素的化合价发生变化,分别由+5价、-1价变化为0价,电子转移方向和数目可表示为 ,
,
故答案为: ;
;
(3)反应物IO3-中I元素化合价降低,IO3-为氧化剂,NaI中I元素化合价升高,I-为还原剂,故答案为:IO3-,I-;
(4)反应生成碘,淀粉遇碘变蓝色,反应中氧化产物和还原产物的物质的量之比为 5:1,故答案为:淀粉溶液变蓝; 5:1.
故答案为:淀粉、食盐、NaI、HCl;
(2)反应中只有碘元素的化合价发生变化,分别由+5价、-1价变化为0价,电子转移方向和数目可表示为
 ,
,故答案为:
 ;
;(3)反应物IO3-中I元素化合价降低,IO3-为氧化剂,NaI中I元素化合价升高,I-为还原剂,故答案为:IO3-,I-;
(4)反应生成碘,淀粉遇碘变蓝色,反应中氧化产物和还原产物的物质的量之比为 5:1,故答案为:淀粉溶液变蓝; 5:1.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握元素化合价的变化,为解答该题的关键,难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
有X、Y、Z三种金属,把Y投入XCl2溶液中一段时间后,溶液质量增大,把Z投入YSO4溶液中一段时间后,溶液的质量减小,则这三种金属的还原性由强到弱的顺序正确的是( )
| A、X>Y>Z |
| B、Y>X>Z |
| C、Z>Y>X |
| D、Z>X>Y |
下列反应属于氧化还原反应的是( )
| A、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| B、CaCO3═CaO+CO2↑ |
| C、Na2O+H2O═2NaOH |
| D、Mg+2HCl═MgCl2+H2↑ |
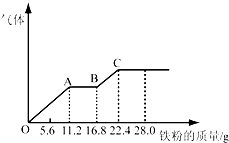 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示.下列分析或结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示.下列分析或结果不正确的是( )| A、混合酸中HNO3物质的量浓度为2mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、原混合酸中H2SO4物质的量为0.4 mol |
| D、第二份溶液中最终溶质为FeSO4 |