题目内容
氨气是一种化工原料.
(1)请写出工业上合成氨的化学方程式:
(2)实验室中,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
(3)请设计一个操作简单的实验,验证NH3?H2O是弱电解质.
(4)甲同学把制得的氨气溶于适量水中,得到稀氨水,用标准浓度的盐酸滴定,测定其浓度.实验步骤:准确量取10.00mL稀氨水于锥形瓶中,加入20mL水稀释,滴加 溶液作为指示剂(填“石蕊”、“酚酞”或“甲基橙”),将 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至 ,停止滴定,记录数据.重复滴定2次.平均消耗盐酸Vml.计算原稀氨水的物质的量浓度= (只列出算式,不做运算)
(1)请写出工业上合成氨的化学方程式:
(2)实验室中,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.

| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 反应的化学方程式为 ① | |
| 乙小组 | 浓氨水、氢氧化钠固体 | 氢氧化钠的作用:氨水中存在平衡:NH4++OH-?NH3?H2O?NH3+H2O,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动. |
(4)甲同学把制得的氨气溶于适量水中,得到稀氨水,用标准浓度的盐酸滴定,测定其浓度.实验步骤:准确量取10.00mL稀氨水于锥形瓶中,加入20mL水稀释,滴加
考点:氨的制取和性质
专题:实验设计题
分析:(1)工业上用氮气和氢气在高温高压催化剂条件下制取氨气;
(2)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;
(3)NH4Cl溶液显酸性说明氯化铵是强酸弱碱盐,则证明NH3.H2O是弱电解质,据此解答即可;
(4)依据中和滴定的原理选择指示剂,依据精确度选择浓度;依据达到滴定终点的特点回答;令10.00mL氨水溶液中稀氨水的浓度为cmol/L,根据消耗的盐酸列方程计算c的值.
(2)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;
(3)NH4Cl溶液显酸性说明氯化铵是强酸弱碱盐,则证明NH3.H2O是弱电解质,据此解答即可;
(4)依据中和滴定的原理选择指示剂,依据精确度选择浓度;依据达到滴定终点的特点回答;令10.00mL氨水溶液中稀氨水的浓度为cmol/L,根据消耗的盐酸列方程计算c的值.
解答:
解:(1)工业上用氮气和氢气在高温高压催化剂条件下制取氨气,该反应为可逆反应,反应方程式为N2+3H2
2NH3,故答案为:N2+3H2
2NH3;
(2)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2,
故答案为:氢氧化钙固体、氯化铵固体;2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出,
故答案为:B;
(3)NH4Cl溶液显酸性说明氯化铵是强酸弱碱盐,则证明NH3.H2O是弱电解质,故验证NH3?H2O是弱电解质的方法是:配制NH4Cl溶液,用pH计测量其pH值,若pH值小于7,则NH3?H2O是弱电解质;故答案为:配制NH4Cl溶液,用pH计测量其pH值,若pH值小于7,则NH3?H2O是弱电解质;
(4)依据利用盐酸滴定氨水,中和后溶液仍然呈酸性,故选择甲基橙作为指示剂;因为题干中数字精确到小数位后第4位,故选择0.1980mol/L的盐酸;溶液达到滴定终点的标志是:溶液由黄色变为橙色,且半分钟不恢复原来颜色;令10.00mL溶液中氢氧化钡的浓度为cmol/L,则:
10.00×10-3×cmol/L=0.1980mol/L×V×10-3L,解得c=
mol/L,
故答案为:甲基橙; 0.1980; 溶液由黄色变为橙色,且半分钟不恢复原来颜色;
mol/L.
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
(2)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:氢氧化钙固体、氯化铵固体;2NH4Cl+Ca(OH)2
| ||
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出,
故答案为:B;
(3)NH4Cl溶液显酸性说明氯化铵是强酸弱碱盐,则证明NH3.H2O是弱电解质,故验证NH3?H2O是弱电解质的方法是:配制NH4Cl溶液,用pH计测量其pH值,若pH值小于7,则NH3?H2O是弱电解质;故答案为:配制NH4Cl溶液,用pH计测量其pH值,若pH值小于7,则NH3?H2O是弱电解质;
(4)依据利用盐酸滴定氨水,中和后溶液仍然呈酸性,故选择甲基橙作为指示剂;因为题干中数字精确到小数位后第4位,故选择0.1980mol/L的盐酸;溶液达到滴定终点的标志是:溶液由黄色变为橙色,且半分钟不恢复原来颜色;令10.00mL溶液中氢氧化钡的浓度为cmol/L,则:
10.00×10-3×cmol/L=0.1980mol/L×V×10-3L,解得c=
| 0.1980×V×10-3 |
| 10.00×10-3 |
故答案为:甲基橙; 0.1980; 溶液由黄色变为橙色,且半分钟不恢复原来颜色;
| 0.1980×V×10-3 |
| 10.00×10-3 |
点评:本题考查物质成分与含量测定、对实验方案的理解与设计、溶液配制、中和滴定、化学计算等,题目综合性较大,难度中等,侧重对实验方案设计与化学计算,是对学生综合能力的考查.

练习册系列答案
相关题目
四种短周期元素的离子:aXm+、bYn+、cZn-、dRm-,它们具有相同的电子层结构,若m>n,下列叙述正确的是( )
| A、m-n=b-a |
| B、元素原子序数a>b>c>d |
| C、元素非金属性:R>Z |
| D、最高价氧化物对应水化物的碱性X>Y |
下列可以大量共存且形成无色溶液的一组离子应该是( )
| A、Ag+、Cu2+、NO3-、Na+ |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、Na+、Ca2+、Cl-、CO32- |
| D、K+、Ba2+、Cl-、NO3- |
下列分子的键角数据错误的是( )
| A、P4:60° |
| B、SiH4:109°28, |
| C、BF3:120° |
| D、H2S:180° |
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol NH4+ 所含质子数为10NA |
| B、常温常压下,11.2L氢气含有NA 个氢原子 |
| C、标准状况下,22.4 L H2O所含的分子数为NA |
| D、常温常压下,32 g O2和O3的混合气体所含原子数为2NA |
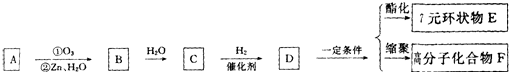
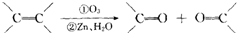 ,这两步反应合称为“烯径的臭氧化分解”.又知结构为R-CO-X(名叫酰卤)的有机物可发生如下的反应:R-CO-X+H2O→R-CO-OH+HX
,这两步反应合称为“烯径的臭氧化分解”.又知结构为R-CO-X(名叫酰卤)的有机物可发生如下的反应:R-CO-X+H2O→R-CO-OH+HX